
题目列表(包括答案和解析)
2.下列说法不正确的是
A.研究物质的性质,常用观察、实验、分类、比较等方法;研究物质的结构,常利用模型、假
说等方法
B.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
C.硅是将太阳能转化为电能的常用材料
D.先开发资源再治理环境的发展理念符合可持续发展的基本国策
1.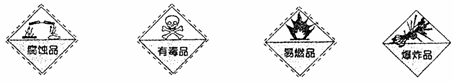 对于易燃易爆有毒有腐蚀性的化学物质,往往会在其包装上贴危险警告标签。下图所列物质与危险警告标签对应错误的是
对于易燃易爆有毒有腐蚀性的化学物质,往往会在其包装上贴危险警告标签。下图所列物质与危险警告标签对应错误的是
A.浓硫酸 B.金属汞 C.四氯化碳 D.硝酸铵
27.(8分)(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试纸检验Cl2的性质 ;
②分液漏斗(分液) ;
(2)下列有关实验的叙述中,合理的是 (多选倒扣分)
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
26.(14分)(I)有一包白色粉末,可能含有NaHSO4 KHCO3 Ba(NO3)2 CaCl2 NaNO3 MgSO4中的一种或几种。
(1)取少量粉末投入水中,既有气体又有沉淀产生;
(2)过滤,取少量滤液,加入AgNO3溶液,无沉淀产生;
(3)再取少量滤液,加入NaOH溶液,也无沉淀产生。
推断白色粉末中一定有 ,一定没有 ,不能肯定有没有的是 。
(II)现有A、B、C、D、E五种盐溶液,分别由K+、NH+4、Ag+、Ba2+、Al3+、Cl-、Br-、CO2-3、SO2-4、NO-3中的阳离子与阴离子各一种组成(五种盐所含阴、阳离子各不相同)。
已知:①A+B→白↓;②A+C→白↓;③A+D→白↓;④BC+H2O→白↓+气体;⑤A的溶液呈中性;⑥B的溶液中c(OH-)>c(H+);⑦C、D、E三种溶液的pH<7。
根据以上事实,回答下列问题:
(1)写出化学式:C D E 。
(2)用离子方程式表示:B的溶液中c(OH-)>c(H+)的原因 。
25.(13分)A、B、C、D均为短周期元素。A、B可形成两种液态化合物甲和乙,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与乙分子的电子数相等,Y分子与甲分子中的电子数相等。
请回答:
(1)A元素为 。
(2)常温下,pH为a的Y溶液与pH与b的氢氧化钠溶液按体积比1:10混合后,正好完全反应,则a与b的关系为 。
(3)已知X在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子,请写出它电离方程式: 。
(4)将X和Y的稀溶液按某种比例混合,
①若所得溶液中只含一种溶质,则该溶质是 ,溶液中离子浓度的大小顺序为 ;
②若该溶液是由体积相等的X和Y溶液混合而成,且恰好呈中性,则混合前c(X) c(Y),混合前酸中c(H+)和碱中c(OH-)的关系c(H+) c(OH-)(填“大于”、“等于”、“小于”)。
24.(10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(化煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g)
CH3OH(g) 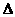 H=-90.8kJ·mol-1
H=-90.8kJ·mol-1
②2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g) 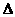 H=-23.5kJ·mol-1
H=-23.5kJ·mol-1
③CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g) 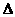 H=-41.3kJ·mol-1
H=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 。
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 。
a.高温高压 b.低温低压 c.减少CO2的浓度
d.增加CO的浓度e.分离出二甲醚 f.加入催化剂
(4)已知反应②CH3OH(g)  CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率的大小:v正 v逆(填“<”、“>”或“=”),若上述情况达到平衡,此时c(CH3OH)= 。
23.关于下列四个图象的说法中正确的是 ( )
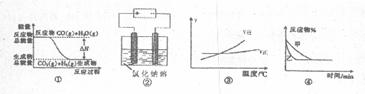
A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的
CO2(g)+H2(g)”中的 大于0
大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的
2AB3(g)”的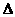 H小于0
H小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
第Ⅱ卷(非选择题 共45分)
22.Na3N与NaH均为离子化合物,都能与水反应放出气体。下列有关叙述正确的是( )
A.二者中Na+半径都比阴离子大
B.与水反应时,水都作氧化剂
C.与水反应所得溶液均能使酚酞试液变红
D.二者与盐酸反应,前者可产生两种盐,后者只有一种盐生成。
21.向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是 ( )
A. B.
B.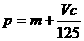 C.
C.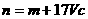 D.
D.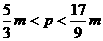
20.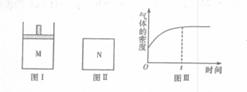 在恒压密闭容器M(如图I)和恒容密闭容器N(如图Ⅱ)中,分别加入a molX和a molY,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2X(?)+Y(?)
在恒压密闭容器M(如图I)和恒容密闭容器N(如图Ⅱ)中,分别加入a molX和a molY,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2X(?)+Y(?) xZ(g) △H<0。平衡时M中X、Z的物质的量之比为1:3:4。下列判断正确的是 ( )
xZ(g) △H<0。平衡时M中X、Z的物质的量之比为1:3:4。下列判断正确的是 ( )
A.x=4
B.若N中气体的密度如图Ⅲ所示,
则X、Y都是气态
C.若X为气体,Y为非气体,则平衡时M、N中Z的物质的量相等
D.若X、Y均为气体,平衡时M中X的转化率小于N中X的转化率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com