
题目列表(包括答案和解析)
20.(13分)锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4和碳粉涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
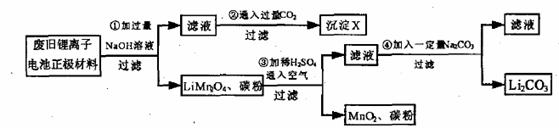
(1)第①步反应可能产生气体的化学式是 ;第②步反应得到的沉淀X的化学式为 。
(2)第③步反应有锂离子(Li+)生成,其反应的离子方程式是 。
(3)四步实验都包含过滤,实验室中过滤实验要使用的玻璃仪器包括 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0 mL 3.0 mol·L-1的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有 g Na2CO3参加了反应。
19.(12分)在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0。CO和H2O浓度变化如下图:
CO2(g)+H2(g) △H<0。CO和H2O浓度变化如下图:
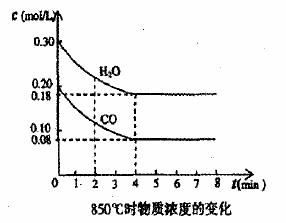
(1)0一4min的平均反应速率v(CO)= mol/(L·min)。
(2)850℃时,平衡常数K= 。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为 。
(4)能判断该反应达到化学平衡状态的依据是 (填选项序号)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
18.(12分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和金属钙Ca,并含有3。5%(质量分数)CaO。
(1)Ca元素原子结构示意图 ,Ca(OH)2碱性比Mg(OH)2 (填“强”或“弱”)。
(2)Ca与非金属最强的元素A形戒化合物D,D的电子式为 。
|
(3)配平用钙线脱氧脱鳞的化学方程式:P+FeO+CaO
Ca3(PO4)2+Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n。则金属M为 (填元素符号);检测Mn+最常用的试剂是 (填化学式)。
(5)取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3 g.
17.(15分)V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成气态化合物M的水溶液呈碱性,W的单质在X2中燃烧的产物可使品红溶液褪色,V是一种历史悠久,应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的化合物一种用途: 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。
(4)若将V金属投入到盐酸溶液中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式: 。
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl一4NHCl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
(6)W(a)+O2(g) WO2(g);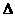 H1 W(g)+O2(g)
H1 W(g)+O2(g) WO2(g);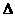 H2
H2
则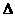 Hl
(填“>”或“(”或“=”)
Hl
(填“>”或“(”或“=”) H2。
H2。
16.实验室常用硫酸铜溶液吸收气体中的硫化氢:
CuSO4+H2S CuS↓+H2SO4,该反应可以推测 ( )
A.CuS易水解
B.CuS可溶于盐酸
C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大
D.强酸可以制取弱酸
第Ⅱ卷(非选择题52分)
15.从海水中提取镁的工艺流程如下图所示:
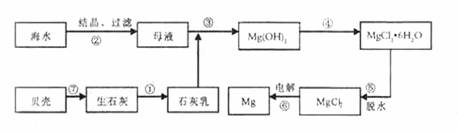
下列说法错误的是 ( )
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤可将晶体置于HCI气体氛围中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
14.有关常温下pH均为3的醋酸溶液和盐酸的说法正确的是 ( )
A.两种溶液中,由水电离出的氢离子浓度均为l×10“1 mal.L-1
B.分别加水稀释100倍后,两种溶液的pH仍相等
C.中和同体积的这两种酸溶液所需要NaOH物质的量也相等
D.分别加入足量锌片,两种溶液生成H2的体积相等
13.能够使反应Cu+2H2O
Cu(OH)2+ H2↑发生的是 ( )
A.用铜片作阴、阳极,电解氯化铜溶液
B.用铜片作阴、阳极,电解硫酸钾溶液
C.铜锌合金在潮湿空气中发生电化学腐蚀
D.铜片和碳棒用导线相连后同时插入一烧杯内的氯化钠溶液中
12.下列离子组一定能大量共存的是 ( )
A.甲基橙呈红色的溶液中:I-、Cl一、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、A1O2-、NO3-、HCO3-
C.含大量OH -的溶液中:CO32-、Cl-、F-、K+
D.含大量Al3+的溶液中:K+、Na+、NO3-、C1O-
11.下列化学实验相应的离子方程式正确的是 ( )
A.向Ba( OH)2溶液中滴加稀盐酸:2H++2C1- +Ba2+ +2OH-=2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:2Fe3+ +Fe 3Fe2+
C.往澄清石灰水中通入过量二氧化碳:Ca2+ +2OH -
+CO2 CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:Fe3+
+Cu Fe2++Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com