
题目列表(包括答案和解析)
20.(14分)
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下
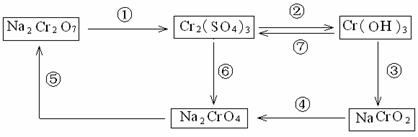
回答下列问题:
(1)上述转化关系中属于氧化还原反应的是 (填编号)。
(2)反应⑤是可逆反应,向黄色的Na2CrO4溶液中加入稀硫酸,溶液逐渐变成橙色,写出该反应的离子方程式 。
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式: 。
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是 。
(5)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,其原理是以碳作阴极,铁作阳极,电解含NaCl、Cr2O72-的酸性废水。
写出电极反应和溶液中进行的反应的离子方程式:
阳极_____ __ ;阴极_______ ____ ;
溶液中________________ ___________ 。
2010-2011学年第一学期临淄中学模块学分认定考试
19.(18分)将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c (HA) = c (NaOH) =0.lmol/L,测得混合后溶液的pH>7。
① 不能证明HA是弱电解质的方法是
A.测得0. 1mol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
② 混合溶液中,关系式一定正确的是
A.c(A-)>c(Na+)c(OH-)>c(H+) B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L D.c( HA) +c( H+)=c(OH-)
③ 若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC, 则相同pH的 ①NaA溶液 ②Na2B溶液 ③NaHB溶液 ④NaC溶液,其物质的量浓度由大到小的顺序为 (填序号)。
(2)若c( HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为 。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)= 0.04 mol/L,c(NaOH)==0.02 mol/L。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+) c (CN-)(填“小于”、“等于”或“大于”),得出该结论的依据是 。
②若HA为CH3COOH,该溶液显酸性,溶液中所有离子按浓度由大到小排列的顺序是 。
③若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为 mol/L(假设混合后溶液体积为两溶液体积之和)。
18.(16分)
火力发电厂产生大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为______________________________。
 (2)脱碳。将CO2转化为甲醇的化学方程式为:
(2)脱碳。将CO2转化为甲醇的化学方程式为:
CO2+3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
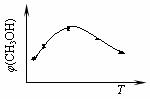
① 取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,tmin后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述合成甲醇的反应的逆反应为_____反应(填“放热”或“吸热”)。
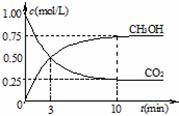 ② 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是________
② 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是________
A.10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5 mol·L-1
B.0~10 min内,氢气的平均反应速率为0.075 mol·L-1·min-1
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
③能说明CO2(g)+3H2(g) CH3OH(g)+H2O(g)达到平衡状态的是______
CH3OH(g)+H2O(g)达到平衡状态的是______
A.生成甲醇的速率与生成水的速率相等
 B.v(H2)=3v(CH3OH)
B.v(H2)=3v(CH3OH)
C.恒容容器中,体系的压强不再改变
D.恒容容器中,混合气体密度不再发生改变
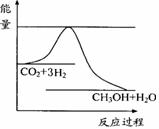
④右图表示反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是____。
CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是____。
 A.使用新高效催化剂
B.充入He(g),使体系压强增大
A.使用新高效催化剂
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2和3mol H2
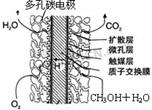
⑤甲醇燃料电池结构如图所示,其工作时正极的电极反应式可表示为_______________________。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。
硫酸铵溶液的pH<7,其原因为:__________(用离子方程式表示);在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)_____c(NO3-)(选填“大于”、“等于”或“小于”)
17.(12分)请按要求完成下面各小题。
Ⅰ.(3分)玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是
①用pH试纸测定NaHCO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
Ⅱ.(4分)设计简单实验证明:氧化性Cl2>FeCl3>KI。简述实验步骤、现象和结论。
可供选用的试剂有:氯水、氯化铁溶液、碘水、氢氧化钠溶液、稀硫酸、硫氰化钾溶液、碘化钾淀粉溶液、氯化亚铁溶液、过氧化氢溶液、蒸馏水;仪器为中学化学实验常用仪器,自选。
Ⅲ.(5分)实验室用表面带有少量铁锈(Fe2O3·xH2O)的铁屑制取绿矾(FeSO4·7H2O)。
①实验中应控制药品量的使用,应使 (填名称)稍过量。
②制备过程中有关反应的化学方程式:
③反应结束后精制绿矾,精制过程中需将溶液加热至50℃-80℃。为减少过滤时绿矾的损失,应将溶液 。
16.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
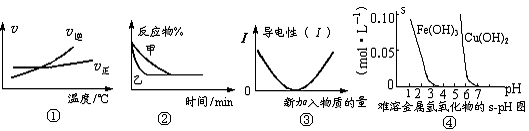
A.根据图①可判断可逆反应A2(g)+3B2(g)  2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙曲线表示的压强大
3C(g)+D(s)的影响,乙曲线表示的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调pH=4-5
第Ⅱ卷(共60分)
15.根据相关化学原理,下列判断正确的是
A.若X和Y是同主族元素,且Y位于X的下方,则其单质的熔点:X<Y
B.NaHCO3溶液中,c(H+)<c(CO32-)
C.若R2+和M+的电子层结构相同,则原子序数:R<M,离子半径:R2+<M+
D.若非金属性:X>Y,则其氢化物的稳定性:HX>HY
14.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
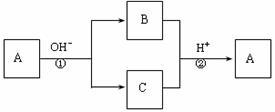
A.X元素可能为Al B.X元素不一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应
13.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.1mol·L-1 Na2SO4溶液中所含钠离子数为2NA
B.6.4g铜与足量硫粉充分反应,转移的电子数为0.2 NA
C.某温度下,1L pH=6的纯水中,所含OH-离子数为1.0×10-6NA
D.3.9g Na2O2固体中含有的阴离子数为0.1NA
12.如图是某课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是
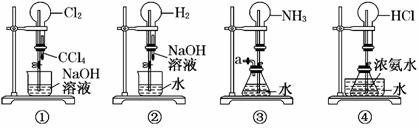
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
11.下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:K+、Fe2+、C1-、NO3-
B.加入Al能放出H2的溶液中:NH4+、SO42-、C1-、HCO3-
C.在含有大量Fe3+的溶液中:NH4+、C1-、Na+、SCN-
D.由水电离的c(OH-)=10-13mol·L-1的溶液中:Ba2+、Na+、C1-、Br-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com