
题目列表(包括答案和解析)
27.(14分)A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与H分别为同一主旅,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)
____,E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示)
__ __ > > 。
(2)一定条件下,A的单质与C的单质充分反应可生成气体W,W的结构式为
由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解生成Y,X的电子式为 。固体化合物E2D2与化合物E2H的水溶液按物质的量之比1:1反应生成单质H的离子方程式为: 。
(3)G是非金属元素,其单质在电子工业中有重要应用,请写出G的最高价氧化物与B的单质在高温下发生置换反应的化学反应方程式: 。
(4)在10 L的密闭容器中,通入2mol HD2气体和1 mol D2气体,一定温度下反应后生成HD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时HD2的转化率为 ;该反应的热化学方程式为
;此时该反应的平衡常数K= 。
26.(14分)
下图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。
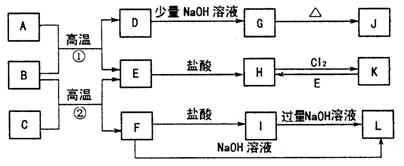
请回答下列问题:
(1)工业冶炼C的化学方程式是 。
(2)在少量H溶液中加入NaOH溶液时的现象是 。
(3)在G、I、J、K的水溶液中,呈酸性的是 (填字母编号,下同);在
B、D、F中,属于两性氧化物的是 。
(4)写出D与J的稀溶液反应生成G的化学方程式: 。
(5)写出L溶液中通入过量D时发生反应的离子方程式: 。
(6)写出在溶液K中通入SO2气体时发生反应的离子方程式: 。
向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

(2)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。
则Cl2、HIO3、HbrO3的氧化性由强到弱的顺序是 。
25.(10分)
科学家预言,燃料电池是21世纪获得电能的重要途径。一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
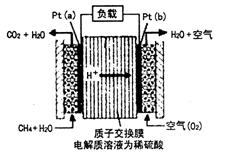
请回答下列问题:
(1)Pt(a)电极是电池的 极,其电极反应式为 。
Pt(b)电极发生 反应(填“氧化”或“还原”),其电极反应式为 。
(2)如果该电池工作时电路中通过2 mol电子,则消耗CH4的物质的量为 mol。
(3)25℃、101 kPa时,若CH4在氧气中直接燃烧生成1mol水蒸气放热401 kJ,写出该反应的热化学方程式 ;若lg水蒸气转化成液态水放热2.445 kJ,则CH4的燃烧热为 kJ/mol。
23.下列各表述与示意图不一致的是 ( )
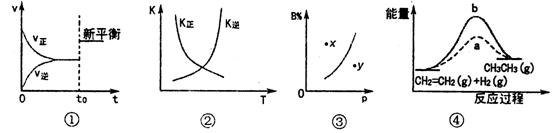
A.图①表示一个可逆反应达到平衡状态后又可能使用了催化剂
B.图②中曲线表示反应2SO2(g)+O2(g) 2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化
2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化
C.对反应aA(g)+bB(g) cC(g)来说,图③x点表示在相应的压强条件下该反应正在向正反应方向进行
cC(g)来说,图③x点表示在相应的压强条件下该反应正在向正反应方向进行
D.图④中a、b曲线分别表示反应CH2=CH2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
第Ⅱ卷(非选择题共76分)
22.下列相关实验不能达到预期目的的是 ( )
|
|
相关实验 |
预期目的 |
|
A |
相同温度下,等质量的大理石块、大理石粉分别与等湾积、等浓度的盐酸反应 |
探究接触面积对化学反应速率的影响 |
|
B |
把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 |
探究温度对化学平衡的影响 |
|
C |
在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 |
探究蔗糖水解产物具有还原性 |
|
D |
两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入FeCl3溶液 |
探究FeCl3溶液对H2O2分解速率的影响 |
21.在25℃时,用石墨电极电解2.0 L2.5 mol/LcuSO4溶液(假设溶液的体积在电解前后不发生变化)。5 min后,在一个石墨电极上有6.4 g Cu生成。下列说法中正确的是( )
A.有Cu生成的一极是阴极,发生氧化反应
B.反应中转移电子的物质的量为0.4 mol
C.在另一极得到O2的体积(标准状况)是1.12L
D.此时溶液的pH为2
20.已知几种难溶电解质的溶度积常数Ksp(25℃)见下表:
|
难溶电解质 |
AgCl |
AgBr |
AgI |
Ag2SO4 |
Ag2CrO4 |
|
Ksp |
1.8×10-10 |
5.4×10-13 |
8.5×10-17 |
1.4×10-5 |
1.12×10-12 |
下列叙述不正确的是 ( )
A.Ksp的大小与三种卤化银见光分解的难易无关
B.将等体积的4×10-3mol·L-1的AgNO3溶液和4×10-3mol·L-1K2CrO4溶液混合,有Ag2CrO4沉淀产生
C.向AgCl的悬浊液中滴加饱和Nal溶液可以得到黄色AgI悬浊液
D.向100 mL 0.1mol·L-1的Na2SO4溶液中加入1 mL 0.1 mol·L-1的AgNO3溶液,有白 色沉淀生成
19.锌与100 mL18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1L,测得溶液的pH=1,下列叙述不正确的是( )
A.反应中共消耗1.8mol H2SO4
B.气体甲中SO2与H2的体积比为4:1
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
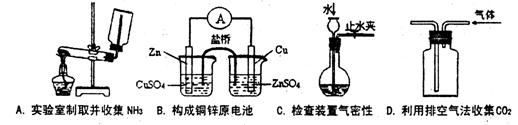
18.下列装置或操作能达到实验目的的是 ( )
17.Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2 Li2S2O4。下列说法正确的是 ( )
Li2S2O4。下列说法正确的是 ( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极的电极反应式为:Li++e-=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com