
题目列表(包括答案和解析)
5.下列五种有色溶液与SO2作用,均能褪色,其实质相同的是
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤淀粉-碘溶液
A.①④ B.①②③ C.②③④ D.②③⑤
4.下列事实不能说明金属元素甲的失电子能力一定比乙强的有
A.甲单质能从乙的盐溶液中置换出乙
B.甲、乙单质用导线连接后插入稀硫酸中,甲单质表面产生气泡
C.甲、乙两短周期元素原子的电子层数相同,甲的原子半径大于乙
D.甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
3.从下列实验事实得出的相应结论中正确的是
|
|
实验事实 |
结论 |
|
A |
某气体能使湿润淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
B |
SO2通入Ba(NO3)2溶液中出现白色沉淀 |
BaSO3不溶于水 |
|
C |
Na2SiO3溶液中通入CO2产生白色沉淀 |
酸性H2CO3>H2SiO3 |
|
D |
某溶液中加入稀盐酸产生无色无味、能使澄清石灰水变浑浊的气体 |
该溶液中一定含有CO2-3 |
2.下列叙述不正确的是
A.元素的化学性质主要取决于原子的最外层电子数
B.16O、17O和18O互为同位素,化学性质基本相同
C.相同温度下,在任何物质的水溶液中,水的离子积(KW)都是恒定值
D.弱电解质溶液的导电能力一定比强电解质溶液的导电能力弱
1.化学知识在生产和生活中有着重要的应用。下列说法中不正确的是
A.生产生活中排放的大量CO2等是导致温室效应的主要原因
B.金属钠、镁着火时,可以使用泡沫灭火器来灭火
C.二氧化硅广泛用于制作光导纤维
D.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
2.考生请将第Ⅰ卷选择题的正确选项涂写在答题卡上,考试结束后,只收第Ⅱ卷和答题卡。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27
Cl-35.5 Fe-56
第Ⅰ卷(选择题,共48分)
1~16小题,每小题3分,共48分。每小题只有一个选项符合题意
1.本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间90分钟。
30.(10分)
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然看放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g.水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
29.(14分)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
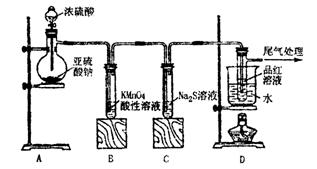
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__ ,其中发生反应的化学方程
式为 。
(2)实验过程中,装置C中发生的现象是 ,说明SO2具有 (填
“氧化性”或“还原性”)。
(3)装置D的目的是探究SO2与晶红作用的可逆性,请写出实验操作及现象:
(4)尾气可采用足量 (填化学式)溶液吸收,有关反应的离子方程式是
。
(5)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(写出一种即可):
28.煤化工常常需要研究不同温度下的平衡常数、投料比及热值等问题。已知反应
CO(g)+H2O2(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)上述正向反应的△H= 0(填“>”或“<”)。
(2)若在800℃时进行上述反应,各物质以不同的物质的量(单位:mol)组合分别投入
恒容反应器,则向正反应方向移动的有 (填字母编号)。
|
|
A |
B |
C |
D |
E |
|
CO2 |
3 |
1 |
0 |
1 |
1 |
|
H2 |
2 |
1 |
0 |
1 |
2 |
|
CO |
1 |
2 |
3 |
0.5 |
3 |
|
H2O |
3 |
2 |
3 |
2 |
1 |
(3)若在500℃时进行上述反应,CO和H2O的起始浓度均为0.020 mol/L,则在该条件下.CO的最大转化率为 .
(4)常温常压下,空气中的C02溶于水,达到平衡时,溶液的pH= 5.60,
c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3第二级电离,则H2CO3 HCO-3+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO-3+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com