
题目列表(包括答案和解析)
2、某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源 ③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 ④不锈钢和目前流通的硬币都是合金 ⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 ⑥豆浆和雾都是胶体。上述说法正确的是 ( )
A.①②④ B.①⑤⑥ C.①③④⑥ D.②③④⑤
1、下列化学用语正确的是 ( )
 A.含有10个中子的氧原子
A.含有10个中子的氧原子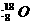 B.乙烯的最简式(实验式):
B.乙烯的最简式(实验式):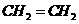
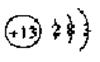 C.
C.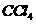 的电子式: D.铝离子的结构示意图
的电子式: D.铝离子的结构示意图
21.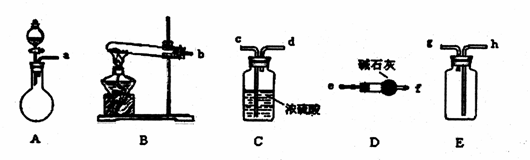 (12分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(12分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室若用NH4Cl和熟石灰作试剂来制取、收集干燥的NH3,则需选用上述仪器装置中的 (填装置序号)。若要制取、收集干燥的CO2,请选择装置并按气流方向连接各仪器接口 。
(2)若在A的分液漏斗内改加浓氨水,圆底烧瓶内加NaOH固体,也能制取氨气。请解释装置A中能产生氨气的原因
。
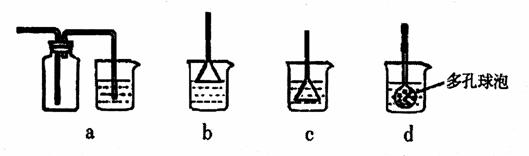 (3)向浓CaCl2溶液中通入NH3和CO2气制纳米级碳酸钙时,应先通入的气体是
,若实验过程中有氨气逸出,应选用下列
装置回收(填代号)。
(3)向浓CaCl2溶液中通入NH3和CO2气制纳米级碳酸钙时,应先通入的气体是
,若实验过程中有氨气逸出,应选用下列
装置回收(填代号)。
写出制纳米级碳酸钙的化学方程式 。
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
20.(12分)据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐。发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是 。
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
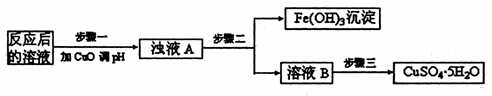
①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
|
|
Ksp |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
2.6×10-39 |
1.9 |
3.2 |
|
Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
步骤一应调节溶液的pH范围是 。请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因
。
②步骤三中的具体操作方法是 。
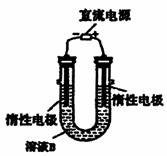
(3)有人提出可以利用右图的装置从溶液B中提炼金属铜。该过程中右边电极的反应式是
,总反应的方程式是 。
 (4)工业上冶炼铜的方法之一为:
(4)工业上冶炼铜的方法之一为:
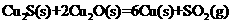

已知:①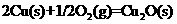
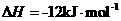
②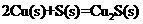
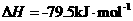
③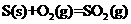
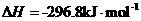
则该法冶炼铜的反应中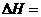 。
。
19.(8分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知: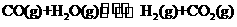 的平衡常数随温度的变化如下表:
的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率
(填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
|
|
A |
B |
C |
D |
|
n(CO2) |
3 |
1 |
0 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
|
n(H2O) |
5 |
2 |
3 |
2 |

(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是 。
18.(11分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

试回答:
(1)若X是强氧性化单质,则A不可能是 。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) ,检验此C溶液中金属元素价态的操作方法是 。
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,X的化学式可能为 ,反应①的离子方程式为 。
17.(9分)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式
。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是 。
A.Ag B.Cu C.Al D.Fe
(4)烧碱、纯碱均可吸收CO2,当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
① ;②Na2CO3;③ ;④NaHCO3
将得到的固体重新溶解于水,在溶液中加盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量是 g。
2.答题前请将密封线内的项目填写清楚
1.第Ⅱ卷请用蓝、黑色钢笔或圆珠笔直接写在答题卷上
16.某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
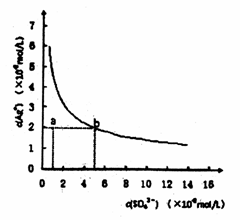 A.含有大量
A.含有大量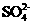 的溶液中肯定不存在
的溶液中肯定不存在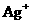
B.0.02mol·L-1的AgNO3溶液与0.02mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
C.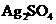 的溶度积常数(
的溶度积常数(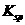 )为1×10-3
)为1×10-3
D.a点表示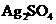 的不饱和溶液,蒸发可以使溶液由a点变到b点
的不饱和溶液,蒸发可以使溶液由a点变到b点
十一五课题调研卷
高三化学
第Ⅱ卷(非选择题,共52分)
注重事项:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com