
题目列表(包括答案和解析)
29. 乙基香草醛(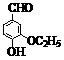 )是食品添加剂的增香原料。
)是食品添加剂的增香原料。
(1)写出乙基香草醛分子中两种含氧官能团的名称_______________________。
(2)与乙基香草醛互为同分异构体,能与NaHCO3溶液反应放出气体,且苯环上只有一个侧链(不含R-O-R’及R-O-COOH结构)的有______种。
(3)A是上述同分异构体中的一种,可发生以下变化:
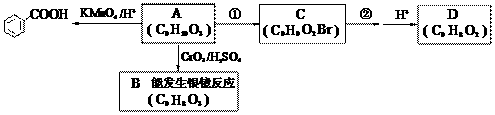
已知:i. RCH2OH RCHO;
RCHO;
ii. 与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
①写出A的结构简式:_______________,反应②发生的条件是_________________。
②由A可直接生成D,反应①和②的目的是___________________________________。
③写出反应方程式:A→B__________________________________________________,
C与NaOH水溶液共热:_____________________________________________________。
(4)乙基香草醛的另一种同分异构体E(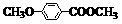 )是一种医药中间体。由茴香醛(
)是一种医药中间体。由茴香醛( )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)_______________________。
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)_______________________。
28. 橡胶是具有弹性的高分子化合物。除天然橡胶外,还有合成橡胶。
(1)天然橡胶的单体为异戊二烯,其结构简式为_________________,系统命名为__________。
(2)异戊二烯的同分异构体有很多,其中只有1个官能团的链烃有_______种。
(3)1,3-丁二烯是最早用于合成橡胶的原料,聚合产物结构随聚合条件、方法及所用催化剂的不同而异。请用化学方程式表示两种聚合方式:① ____________;② ____________。
 (4)橡胶高分子链中由于含有不饱和结构,弹性、强度、耐热和抗氧化性均较差,“硫化”可将橡胶链中的不饱和结构通过硫键(-Sx-)打开彼此相连形成网状结构,以改善其性能。现有某橡胶硫化后的部分结构如下所示:
(4)橡胶高分子链中由于含有不饱和结构,弹性、强度、耐热和抗氧化性均较差,“硫化”可将橡胶链中的不饱和结构通过硫键(-Sx-)打开彼此相连形成网状结构,以改善其性能。现有某橡胶硫化后的部分结构如下所示:
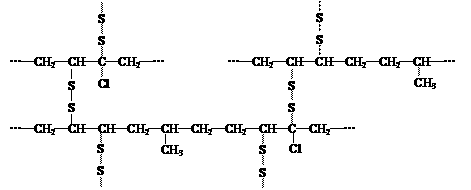
从结构看,合成这种橡胶的单体至少有(用结构简式表示):_____________________________。
27. 红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下:
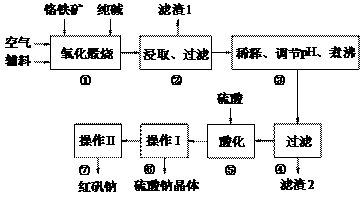
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2
 8Na2CrO4 + 2Fe2O3
+ 8CO2
8Na2CrO4 + 2Fe2O3
+ 8CO2
①中副反应:Al2O3 + Na2CO3  2NaAlO2 + CO2↑,
2NaAlO2 + CO2↑,
SiO2 +
Na2CO3  Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。
 (2)“②”中滤渣1的成分是__________, “③”中调pH值是_______ (填“调高”或“调低”),“④”中 滤渣2的成分是___________。
(2)“②”中滤渣1的成分是__________, “③”中调pH值是_______ (填“调高”或“调低”),“④”中 滤渣2的成分是___________。
(3)“⑤”酸化的目的是使CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:__________________________。
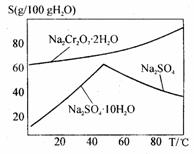
(4)右图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II是______(填序号)。
①蒸发浓缩,趁热过滤 ②降温结晶,过滤
(5)已知某铬铁矿含铬元素34%,进行步骤①~④中损失2%,步骤⑤~⑦中产率为92%,则1吨该矿石理论上可生产红矾钠_______吨(保留2位小数)。
26. 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。
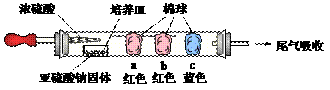
|
棉球 |
棉球上滴加试剂 |
实验现象 |
解释或结论 |
|
a |
_______________ |
棉球变白, 微热后又恢复红色 |
解释:_____________________________ 结论:该气体具有漂白性。 |
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: _________________________ |
|
c |
_______________ |
棉球变为白色 |
化学方程式: _________________________ 结论:该气体具有_________性。 |
(2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入
|
溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。 ① 用此装置模拟工业合成盐酸,则关于试剂选择正确的是________(填序号),管口可观察到_______色火焰。
|
 |
② 若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓浓黑烟,则固体B为_________(填化学式)。此火焰温度极高,叫做________,常用于切割焊接金属。
25. 三种不同条件下,分别向容积固定的2L密闭容器中充入2molA和1mol B,发生反应如下:2A (g) +B (g) 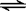 2D (g) + Q,相关条件和数据见下表。
2D (g) + Q,相关条件和数据见下表。
|
|
实验I |
实验II |
实验III |
|
反应温度 / ℃ |
800 |
800 |
850 |
|
达平衡时间 /min |
40 |
10 |
30 |
|
c( D )平衡 /mol·L-1 |
0.5 |
0.5 |
0.15 |
|
反应的能量变化 / kJ |
Q1 |
Q2 |
Q3 |
请回答:
(1)实验III,反应进行到30min时的平均速率v (D)为_________________。
(2)实验II可能隐含的反应条件是________________________________________。
(3)下列描述中能说明上述反应已达平衡的是__________(填序号)。
a. c(A) = 2 c(B) b. 2 v (D)正 = v (B)逆
c. 容器内气体密度不随时间而变化 d. 容器内气体压强不随时间而变化
(4)对比上述实验,可知该反应的反应热Q___0(填“>”或“<”),并将Q、Q1、Q2、Q3按从小到大的顺序排列:_______________________________。
(5)若实验I达到平衡后,保持温度不变,再向密闭容器中通入由1mol A和1mol D组成的混合气体,则平衡将_______________移动(填“正向”、“逆向”或“不”),新平衡状态时c(D)为____________mol·L-1。
23. 能源材料已成为当今科学研究的热点。请回答下列问题:
|
|
I1 |
I2 |
I3 |
I4 |
…… |
|
电离能(kJ/mol) |
738 |
1451 |
7733 |
10540 |
…… |
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~ 4个电子所需能量(电离能)如右表所示,某同学推断A的核外电子排布为:1s22s22p63s13p1,该电子排布式违背了____________;若该原子核外电子确有三层,则该元素位于周期表_______族,写出A燃烧后形成的氧化物的电子式:____________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_______(填序号)。
a. C60、Si60、N60都属于新型化合物 b. C60、Si60、N60互为同分异构体
c. 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
|
(3)超导材料在节能、储能方面的应用。右图是超导材料元素在周期表中的分布,其中短周期元素中原子半径最大的是_____(填元素符号),其原子最外层有______种运动状态不同的电子,写出其最高价氧化物对应水化物的电离方程式: _________________________________________。 |
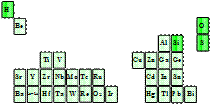 |
|
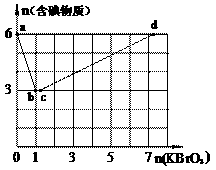
24. 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。请回答下列问题: (1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为_________,还原产物是________。 (2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式_______________。 |
 |
(3)① 已知反应:2BrO3- +I2 → 2IO3- + Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:
____________________________________________________________________________。
②n(KBrO3) = 4时,对应含碘物质的化学式为______________。
(4)含a mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为___________。
22. 常温下,用 0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得滴
|
定曲线如右图。下列说法正确的是 A. 点①所示溶液中: c(CH3COO-) +2 c(OH-) = c(CH3COOH) + 2c(H+) B. 点②所示溶液中: c(Na+) < c(CH3COO-) + c(CH3COOH) C. 点③所示溶液中: c(Na+) > c(OH-) > c(CH3COO-) > c(H+) |
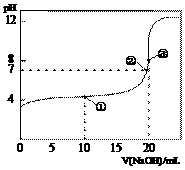 |
D. 滴定过程中可能出现:c(CH3COOH) > c(H+) > c(CH3COO-) > c(Na+) > c(OH-)
第II卷(共84分)
21. 向15.0 mL 1.0 mol·L-1的(NH4)Al(SO4)2溶液中逐滴加入1.0 mol·L-1的NaOH溶液,并不断搅拌。当生成0.78 g沉淀时,所用NaOH溶液的体积可能为
A . 30 mL B. 45 mL C. 50 mL D. 65 mL
20. 下列离子方程式书写正确的是
A. 硫酸铜溶液与氢氧化钡溶液反应:SO42- + Ba2+ → BaSO4↓
B. 稀硝酸中加入少量碳酸亚铁:FeCO3 + 2H+ → Fe2+ + CO2↑+ H2O
C. 硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H+ + OH- → H2O
D. 饱和碳酸钠溶液中通入二氧化碳气体:2Na+ + CO32- + CO2 + H2O → 2NaHCO3↓
19. 已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH
+ H2O 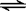 CH3COO- + H3O+ K1=1.75×10-5
CH3COO- + H3O+ K1=1.75×10-5
CH3COO- + H2O 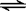 CH3COOH + OH- K2=5.71×10-10
CH3COOH + OH- K2=5.71×10-10
现有50 mL 0.2 mol·L-1醋酸与50 mL 0.2 mol·L-1醋酸钠混合制得溶液甲,下列叙述正确的是
A. 甲溶液的pH >7
B. 对甲进行微热,K1、K2同时增大
C. 若在甲中加入少量的NaOH溶液,溶液的pH几乎不变
D. 若在甲中加入5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的K1会变大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com