
题目列表(包括答案和解析)
3.下列有关化学用语正确的是 ( )
A.氧的原子结构示意图为: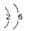
B.用电子式表示水分子形成的过程为: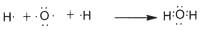
C.2gH2在25℃101kPa下燃烧,生成液态的水放出285.8kJ的热量,则该反应的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-285.8kJ/mol
D.氢氧化铝电离方程式为:Al(OH)3 Al3++3OH-
Al3++3OH-
2.下列说法正确的是 ( )
A.磷酸、碱石灰、绿矾分别属于酸、碱、盐
B.医院里做的“血清纸上电泳"是利用了血清里胶体的粒子大小在lnm~100nm之间
C.石油分馏、煤的气化属于物理变化,石油的裂解、裂化和煤的干馏属于化学变化
D.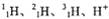 和
和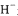 是氢元素的5种不同微粒
是氢元素的5种不同微粒
1.2010年上海举办的世博会主打环保旗帜,下列行为中不符合这一主题的是 ( )
A.大量开采地下水,以满足社会对水的需求
B.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
C.釆用“绿色化学”工艺,使原料尽可能转化为所需要的物质
D.将煤转化为水煤气作燃料
24.(13分)
I:(1)0.0003 mo1·L -1·min-1(2分,无单位扣1分)
(2) ① <(1分) ② V 2/a2 (1分) ③增大,不变(各1分)④0.55(2分)
II:
(2分)
(3) (3分)
(3分)
23.(11分)
(1)Fe(OH)3 、CaSO4 (1分); Na+(填有Ca2+,或SO42- 不给分)。(1分)
布氏漏斗 抽滤瓶或吸滤瓶(各1分)
(2)3NaClO + CO(NH2)2 =3NaCl + CO2 ↑+ N2↑+ 2H2O 或
NaOH +3NaClO + CO(NH2)2 =3NaCl + NaHCO3+ N2↑+ 2H2O (2分)
|
(3)①Mg(OH)Cl = MgO + HCl↑ (2分)
②P(HCl)小,加热时Mg2+ 会发生水解 (1分);
通入HCl ,增大P(HCl),抑制Mg2+ 水解。 (1分)
25.(13分)某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍。A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是 。
(2)已知:
ⅰ. 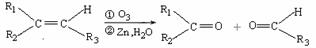 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 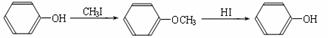
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。
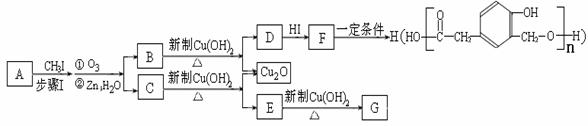
请回答:
① 步骤Ⅰ的目的是 ;
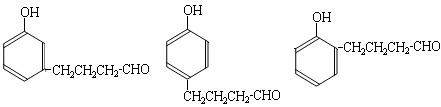
② 若G为气体,且相对分子质量是44,则E的结构简式是 ;E的核磁共振氢谱中有 个吸收峰(填数字);
③ F→H的反应类型是 ;
④ F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式 ;
⑤ A的结构简式是 ;
上述转化中B→D的化学方程式是 。
(3)已知A的某种同分异构体K具有如下性质:
① K与FeCl3反应,溶液呈紫色;
② K在一定条件下可发生银镜反应;
③ K分子中苯环上的取代基上无甲基。
请写出K所有可能的结构简式
 (3)4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑(2分)
(3)4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑(2分)
(也可分步写,其他正确答案参照给分)
(4)滴加KSCN溶液,若溶液呈血红色则为Fe3+(2分)
24.(13分)二甲醚和甲醇被称为21世纪的新型燃料,以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
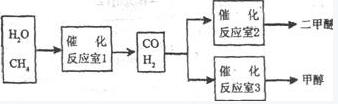
I:(1)在一定条件下,容积为 100 L密闭容器中发生反应:
CH4(g)+H2O(g)
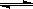 CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器 l0 min时有0.1 mol CO生成,则10 min内该反应的平均速率v(H2) 。
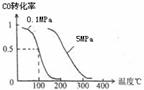 (2) 在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)
(2) 在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
平衡时CO的转化率与温度、压强的关系如图。
①该反应的△H 0 (填“<”、“>”或“=”)。
② 100℃时该反应的平衡常数K= (用含a、V的代数式表示)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。平衡常数 (填“增大”、“减小”或“不变”)
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
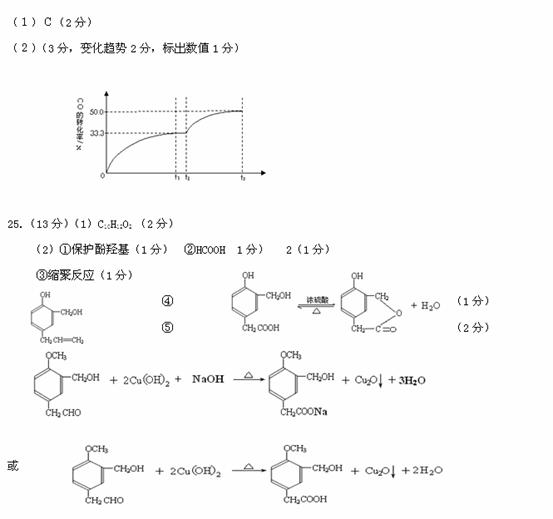
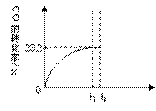
II:某温度下,向密闭容器中充入2.0 mol CO和1.0mol H2O,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g)。CO的转化率随时间变化关系如图,回答下列问题:
CO2(g)+H2(g)。CO的转化率随时间变化关系如图,回答下列问题:
(1)如果一个可逆反应的平衡常数K值很大,下列说法正确的是 (填字母)。
 A.该反应的反应物混合后很不稳定
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应达平衡时至少有一种反应物的百分含量很小
D.该反应一定是放热反应 E.该反应使用催化剂意义不大
(2)t2时刻向平衡体系中再通入1.0 mol H2O(g),请在原坐标图中将改变这一条件后CO的转化率的变化结果表示出来。
23.(11分)温州市地处沿海,海水资源丰富,海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。制备流程如下图:
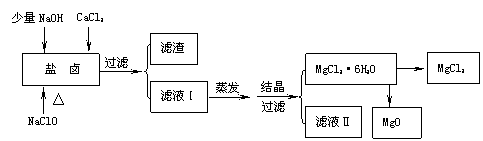
(1)滤渣的成分是 (写化学式);滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。为了加快过滤速度,常采用减压过滤,写出组装减压过滤装置的主要硅酸盐仪器名称 , 。(写2种即可)
 (2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
;
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
;
加入NaClO的另一个作用是 。
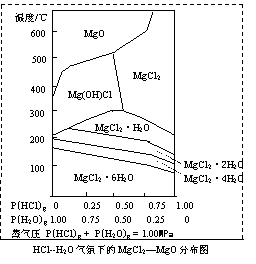
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解 产物的影响如图所示。请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
22.(12分)下图表示有关物质(均是中学化学常见的物质)之间的转化关系(部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体、F为红褐色沉淀。回答下列问题:
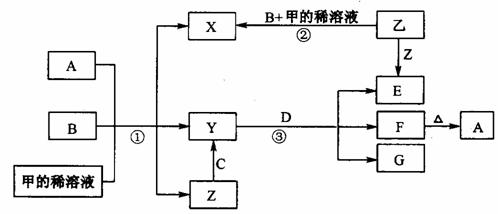
(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应。则甲为 ,C为 (填写化学式)。乙物质的电子式为 , A与B物质的量应满足的关系为 。
(2)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生。请写出反应②发生的化学反应方程式 ,产生气体的原因是 。
(3)写出反应③的离子反应方程式 。
(4)写出Z中阳离子的检验方法 。
21.(6分)化学试剂的生产和电镀工业排放的废水中常含有20-100mg.L-1Cr(Ⅵ),饮用含Cr(Ⅵ)的水会损害人的肠胃等,已知Cr(Ⅲ)的毒性是Cr(Ⅵ)的0.5%,国家规定工业废水含Cr(Ⅵ)的量排放标准为0.1mg.L-1。工业上常用化学法和电解法处理含Cr(Ⅵ)废水,再将Cr(Ⅲ)转化成沉淀除去,某研究性学习小组为研究废水的净化,设计了如下实验流程:
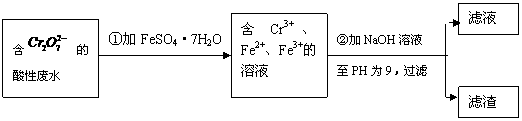
(1)配平第①步反应的离子方程式:

 Cr2O72-
+
Cr2O72-
+ 
 Fe2+ +
Fe2+ + 
 H+
H+ 

 Cr3+ +
Cr3+ + 
 Fe3+ +
Fe3+ + 

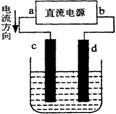
(2)设计一个电解装置也可以实现上述目的,
装置如右图(用铁棒和石墨作电极):
电极材料c为:
d极电极反应为:
(3)已知:25℃ 时Ag2Cr2O7的Ksp=2×10-7。则25℃ 时,将4×10-2mol·L-1的AgNO3溶液与4×10-4mol·L-1的K2Cr2O7溶液等体积混合 (填“能”或“不能”) 析出沉淀。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com