
题目列表(包括答案和解析)
23.(12分)下图是一个电化学过程的示意图。
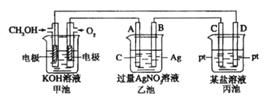
请回答下列问题:
(1)图中甲池是____________________ (填“原电池” “电解池”或“电镀池”)。
(2)A(石墨)电极的名称是__________ (填“正极” “负极” “阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式_________________________
(4)乙池中反应的化学方程式为______________________________
当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为_______L
(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
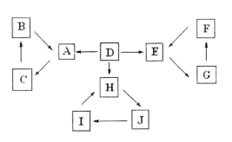
22.(10 分)A、B、C、D、E、F、H、I、J有
如图所示的转化关系。图中所有物质均由短周
期元素组成,且每个小三角形内的三种物质均
至少含有第三周期中的一种相同元素。其它信
息见下表:
|
|
信 息 |
|
1 |
D为地壳中含量最高的元素组成的单质 |
|
2 |
E为酸性氧化物,不溶于水,能与某种酸反应 |
|
3 |
F不溶于水 |
|
4 |
H为淡黄色固体化合物 |
|
5 |
电解饱和J溶液是工业重要反应 |
|
6 |
C为离子化合物,阴、阳离子均含有金属元素。 |
(1)写出F的化学式__________,H的电子式_______________。
 (2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因_______________。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因_______________。
(3)写出向C溶液中通入过量CO2的离子方程式
____________________。
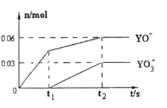
(4)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定
浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反
应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。写出该氢氧化钾溶液中通入Y2的化学方程式:______________________________
21.(12分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]可溶于水;草酸钙(CaC2O4)难溶于水;Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:10≥pH≥5;Fe(OH)3;pH≥8.7。
试根据上述过程及信息填空:
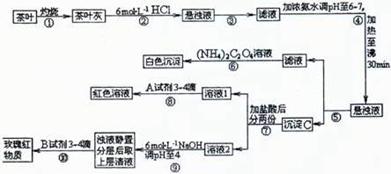
试根据上述过程及信息填空:
(1)步骤③操作中,需要用到铁架台、铁圈、铁夹、烧杯、_____、________等仪器。
(2)步骤②加盐酸的作用是______________________________。
(3)步骤④的目的是_____________________________________________
(4)写出沉淀C所含主要物质的化学式______________________________。
(5)写出步骤⑧发生反应的离子方程式______________________________。
 (6)写出⑨发生反应的离子方程 式 。
(6)写出⑨发生反应的离子方程 式 。
20.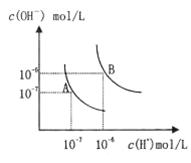 水的电离平衡曲线如图所示,若以A点表示25°C时水的电离达平衡时的离子浓度,B点表示1000C 时水的电离达平衡时的离子浓度,
水的电离平衡曲线如图所示,若以A点表示25°C时水的电离达平衡时的离子浓度,B点表示1000C 时水的电离达平衡时的离子浓度,
则下列说法正确的是 ( )
A.纯水中25°C时的,c(H+)比100℃ 的时c(H+)大
B.1000C时某溶液中由水电离产生的c(H+)=1×10-11
mol·L-1,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,
并保持1000C的恒温,混合溶液的pH=7,则
Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某NaSO2SO4溶液中c(SO22-4)=5×10-4mol/L,则溶液中c(Na+):c(OH-)为104:1
第II卷(答案请写在答题纸上)
19.常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
A.其他条件不变时,在0.1mol·L-1CH3COOH溶液中加水稀释,c(OH-)/c(CH3COOH)的值将增大
B.pH=3的二元弱酸H2R溶液和pH = 11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)=c(Na+)
C.pH=2的HA溶液与pH= 12的BOH溶液等体积混合后溶液pH等于8,则该碱溶液与pH=2的HCl溶液等体积混合时有:c(B+)=c(Cl-)>c(OH-)=c(H+)
D.0.1mol·L-1pH为5的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
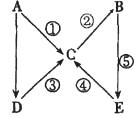
18.A、B、C、D、E五种物质均含有同一元素,且A为单质,
有如图所示的转化关系。则下列判断不正确的是( )
A.若ABCDE中同一元素的价态均不相同,则A为气态单质
B.若A为金属钠,则由ImolD完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可以是氧化还原反应又可以是复分解反应
D.若A为金属铁,则化合物C和D均可以由化合反应生成
17.已知将过氧化钠加入硫酸亚铁盐溶液中发生:
4Fe2++4Na2O2+6H2O==4Fe(OH)3↓O2↑+8Na+,则下列说法正确的是 ( )
 A.该反应中的氧化产物是Fe(OH)3,还原产物是O2
A.该反应中的氧化产物是Fe(OH)3,还原产物是O2
B.该反应的氧化剂是Na2O2,还原剂是FeSO4
C.生成4molFe(OH)3时转移6 mol电子
D.有4molNa2O2完全反应时转移8 mol电子
16.加热N2O5,依次发生的分解反应为①N2O5 N2O3+O2,
N2O3+O2,
②N2O3 N2O+O2;在2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol。则t℃时反应①的平衡常数为 ( )
N2O+O2;在2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol。则t℃时反应①的平衡常数为 ( )
A. 10.7 B. 8.5 C. 9.6 D. 10.2
15.下表各选项中的离子组,在指定的溶液中能够大量共存的是 ( )
|
选项 |
溶液 |
离子组 |
|
A |
与Al反应放出H2 |
Na+、Ca2+、Cl-、HCO3- |
|
B |
使KSCN溶液显红色 |
NH4+ H+、I- SO42- |
|
C |
常温下 c (H+)/c(OH-)=Kw |
Na+、K+、S2-、SO32- |
|
D |
纯碱溶液 |
Na+、Al3+、Cl-、SO42- |
14.下列离子方程式正确的是 ( )
A.向含0.2mol FeBr2的溶液中通入标准状况下的5.6L的Cl2:
5Cl2+4Fe2++6Br-==4Fe3++3Br2+10Cl-
B.次氯酸钙溶液中通入过量的二氧化硫气体ClO-+H2O+SO2==HSO-3+HclO
C.向硫酸亚铁溶液中通入H2S气体Fe2++H2S==FeS↓+2H+
D.Cl2通入石灰乳中制取漂白粉Cl2+2OH-==Cl-+H2O+ClO-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com