
题目列表(包括答案和解析)
7、氮及其化合物:
(1)N2含有三键所以常温下比较稳定,高温或放电的情况下N2→NO。
(2)氨
①氨水溶液的碱性:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
氨气能使湿润的红色石蕊试纸变蓝。
②氨水成分:氨水中有 分子:NH3、H2O、NH3·H2O;离子:NH4+、OH-即“三分子、二离子”。
③实验室制氨气及NH4+的检验:☆☆☆☆☆
△实验室制氨气:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
△NH4+的检验:加入NaOH、加热,产生的气体能使湿润的红色石蕊试纸变蓝。
NH4Cl+NaOH NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
④氨用途之一-----工业制取硝酸
△氨在催化剂的作用下与氧气发生反应,生成NO
4NH3+5O2
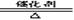 4NO+6H2O(能进行氧化还原反应分析。)
4NO+6H2O(能进行氧化还原反应分析。)
△NO与氧气反应生成NO2 2NO+O2=2NO2
△用水吸收NO2生成硝酸 3NO2+H2O=2HNO3+NO
(3)硝酸的性质-----强氧化性
Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) =Cu(NO3)2+2NO↑+4H2O
C(红热)+4HNO3(浓) =CO2↑+2NO2↑+2H2O
(4)氧化后再氧化的总结:(推断题中常用到,切记!)☆☆☆☆☆
①C→CO→CO2;②N2→NO→NO2;③S→SO2→SO3;④Na→Na2O→Na2O2;⑤醇→醛→酸。
(5)理清氮及其化合物的转化关系:☆☆☆☆☆


|
|
|
|
|

|




6、硫及其化合物:
(1)二氧化硫的性质与作用
①物理性质:无色有刺激性气味的有毒气体,密度比空气大。相似
②化学性质:△SO2+H2O H2SO3
(H2SO3的不稳定性,与H2CO3很相似)
H2SO3
(H2SO3的不稳定性,与H2CO3很相似)
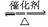 △还原性:2SO2+O2 2SO3
△还原性:2SO2+O2 2SO3
△漂白性:SO2 能与有色物质结合生成不稳定的无色物质。
 物理性漂白---吸附作用-----活性炭(例:红糖→白糖)
物理性漂白---吸附作用-----活性炭(例:红糖→白糖)
 漂白 永久性漂白----强氧化性----- HClO、NaClO、Na2O2、H2O2等等。
漂白 永久性漂白----强氧化性----- HClO、NaClO、Na2O2、H2O2等等。
化学性漂白
暂时性漂白---结合成不稳定物质---SO2---加热、光照会复原。
(2)酸雨:PH<5.6 正常性雨水PH值大约为6 ,是因为水中溶解有CO2的缘故。
硫酸性酸雨的形成原因: SO2 。SO2是首要大气污染物之一。
(主要)化石燃料及其产品的燃烧。
(次要)含硫金属矿物的冶炼、硫酸厂产生的废气
防治:开发新能源,对含硫燃料进行脱硫处理,提高环境保护的意识。
△三大环境问题:酸雨、温室效应、臭氧空洞。
△空气质量日报的主要内容包括“空气污染指数”、“空气质量级别”、“首要污染物”,目前计入空气污染指数的物质暂定为:二氧化硫、氮的氧化物和可吸入颗粒等。
△常见的环境保护问题:①酸雨:SO2;②温室效应:CO2;③光化学烟雾:氮的氧化物;④臭氧层空洞:氯氟烃;⑤白色垃圾:塑料垃圾;⑥假酒:CH3OH;⑦室内污染:甲醛;⑧赤潮:含磷洗衣粉;⑨CO 与NO有毒:与血红蛋白结合;⑩电池:重金属离子污染。☆☆☆☆☆
(3)浓硫酸
浓硫酸的特性
△ 吸水性:作干燥剂,不能干燥碱性气体NH3。
 碱性干燥剂---碱石灰、氧化钙等---干燥碱性气体、中性气体例NH3、H2等
碱性干燥剂---碱石灰、氧化钙等---干燥碱性气体、中性气体例NH3、H2等
干燥剂总结 中性干燥剂---无水氯化钙等---干燥碱性、酸性、中性气体。例H2、N2等
酸性干燥剂---浓硫酸等---干燥酸性气体、中性气体。例Cl2、HCl、N2等
△脱水性:蔗糖的脱水炭化-----注意“黑面包”实验,要重点掌握。
△浓硫酸的强氧化性(普通酸的氧化性是指酸中的H+的氧化性,其还原产物为H2)
与铜反应:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(被还原的硫酸占反应硫酸的1/2,若2mol浓H2SO4与足量Cu反应则被还原的硫酸不满1mol,为什么?同样,4mol浓盐酸与足量MnO2反应,也有类似情况。)
与碳反应:C+2H2SO4(浓) SO2↑+ CO2↑+2H2O(特别要注意此实验的产物检验)
SO2↑+ CO2↑+2H2O(特别要注意此实验的产物检验)
(4)除去CO2中的SO2可用酸性高锰酸钾、溴水、饱和碳酸氢钠溶液。SO2使酸性KMnO4溶液褪色,是其还原性的体现;SO2使溴水褪色,也是其还原性的体现而不是漂泊性。☆☆☆☆☆
(5)理清硫及其化合物的转化关系:☆☆☆☆☆
|


|
|


|
|

|
 O2
O2
H2O
NaOH
O2
O2
H2O
NaOH
O2 BaCl2
5、氯及其化合物:
(1)氯气:黄绿色、有刺激性气味、能溶于水的有毒气体。
氯气具有强氧化性,能与多种金属、非金属反应。与变价金属生成高价态化合物。氢气在氯气中燃烧火焰为苍白色,瓶口有白雾(HCl酸雾)产生。潮湿的氯气有漂白性(HClO)。
(2)新制氯水成分:“三分子、四离子”。如何保存?久置氯水成分?各成分都有其性质。
(3)漂白液(主要指NaClO,例市场上的“84”消毒液)
2NaOH+Cl2=NaCl+NaClO+H2O
(4)漂白粉制取和漂白原理:☆☆☆☆☆
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O漂白粉主要成分和有效成分各为什么?
漂白原理:Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO=2HCl+O2↑
(5)氯气的实验室制法:☆☆☆☆☆
①反应原理:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
②发生装置:圆底烧瓶、分液漏斗等; ③除杂:用饱和食盐水吸收HCl气体;用浓H2SO4吸收水; ④收集:向上排空气法收集(密度比空气大);
⑤检验:使湿润的淀粉碘化钾试纸变蓝;(反应为:2KI+C12 =2KCl+I2)
⑥尾气处理:用氢氧化钠溶液吸收尾气。(反应为:Cl2+2OH-=Cl-+ClO-+H2O)
(6)胃酸的成分是盐酸,NaHCO3、Al(OH)3、CaCO3都可用于治疗胃酸过多。
4、硅及其化合物:
(1)硅单质的用途及制取:硅单质可以作半导体,芯片,太阳能电池。

用氧化还原反应分析硅单质制取:SiO2+2C 2CO↑+Si(粗硅)
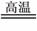 Si+2Cl2
SiCl4
Si+2Cl2
SiCl4
 SiCl4+2H2 Si(纯硅或称精硅)+4HCl
SiCl4+2H2 Si(纯硅或称精硅)+4HCl
(2)SiO2的用途及性质:纯SiO2可以作光导纤维的材料。
SiO2化学性质: 不活泼,耐腐蚀
① 不与水酸(除HF)反应:SiO2+4HF=SiF4↑+2H2O(玻璃瓶不能装HF酸)
SiO2中含CaCO3杂质除去:加足量盐酸,然后过滤、洗涤即可。
②与碱反应:SiO2+2NaOH=Na2SiO3+H2O(实验室装NaOH的试剂瓶用橡皮塞)
离子反应:SiO2+2OH-=SiO32-+H2O
(3)硅酸盐
①水玻璃溶液在空气中变质(变浑浊)的离子反应:
SiO32-+CO2+H2O=H2SiO3↓+CO32-
②硅酸盐工业:水泥、陶瓷、玻璃、砖瓦等都为硅酸盐工业产品。
3、铁及其化合物:
(1)能被磁铁吸引铁质:铁和四氧化三铁(四氧化三铁也叫磁性氧化铁)。
(2)铁的化学性质
①与氧气反应:3Fe+2O2 Fe3O4
Fe3O4
②与非金属反应:2Fe+3Cl2 2FeCl3 Fe+S
2FeCl3 Fe+S  FeS
FeS
(注意:铁与强氧化剂反应为高价,与弱氧化剂反应为低价;铜也一样。)
③与水反应:3Fe+4H2O(g)  Fe3O4+4H2↑
Fe3O4+4H2↑
④与酸反应:Fe+H2SO4=FeSO4+H2↑
⑤与盐反应:Fe+CuSO4=FeSO4+Cu
(4)高、低价铁之间的常见转化关系的反应有:
①化学反应为:2FeCl2+Cl2=2FeCl3 离子反应为:2Fe2++Cl2=2Fe3++2Cl-
②化学反应为:2FeCl3 +Fe=3FeCl2 离子反应为:2Fe3++Fe=3Fe2+
Cu+2FeCl3=CuCl2+2FeCl2 离子反应为:2Fe3++Cu=2Fe2++Cu2+
(5)氢氧化亚铁的制备与变化:
FeCl2+2NaOH=Fe(OH)2↓+2NaCl
(此实验长滴管可以伸入试管底部以减少生成的Fe(OH)2被氧化)
在空气中氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3
颜色变化为:白色→灰绿色→红褐色。
(6)钢铁的腐蚀: 钢铁与周围物质接触发生反应而被侵蚀损耗。
钢铁的腐蚀分为化学腐蚀和电化学腐蚀,后者类似形成铁-碳原电池。
2、铝及其化合物:
(1)铝的存在:铝是地壳中最多的金属元素,主要是以化合态存在,铝土矿主要成分是Al2O3。
(2)铝单质
①铝常温下铝与浓硫酸、浓硝酸钝化。钝化强调三个“两”,即:两种金属(铝和铁),两种酸(浓硫酸和浓硝酸),两个字(“冷即常温”和“浓”)。
②铝与强酸、强碱反应:2Al+3H2SO4=Al2(SO4)3+3H2↑
2Al+2 NaOH+2H2O=2NaAlO2+3H2↑
③铝热反应要重点掌握:2Al+ Fe2O3 2 Fe + Al 2O3 ☆☆☆☆☆
2 Fe + Al 2O3 ☆☆☆☆☆
铝热反应可用于焊接铁轨,制取难熔金属等(利用了铝的还原性)。
(3)典型的两性氧化物:Al2O3
①与硫酸反应:Al2O3+3H2SO4=Al2(SO4)3+3H2O
②与氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O
离子方程式:Al2O3+2OH-=2AlO2-+H2O
(4)典型的两性氢氧化物:Al(OH)3
①与酸反应:Al(OH)3+3HCl=3AlCl3+3H2O
②与氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O
离子反应:Al(OH)3+OH-=AlO2-+2H2O
③ Al(OH)3实验室制取方法: 常用铝盐与足量氨水反应
化学方程:AlCl3+3NH3·H2O=Al(OH)3↓+3 NH4Cl
离子方程:Al3++3NH3·H2O=Al(OH)3↓+3 NH4+
(5)明矾(十二水合硫酸铝钾[KAl(SO4)2·12H2O])常用作净水剂,是因为铝离子与水反应生成氢氧化铝具有 吸附性 吸收了水中悬浮物而下沉净水。
(6)铝土矿制备金属铝的原理:
Al2O3+2NaOH=2NaAlO2+H2O NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
|
|
2Al(OH)3 ===Al2O3+3H2O 2Al2O3(熔融) ===4Al+3O2↑
1、钠及其化合物:
(1)钠的物理性质:银白色固体,导热、电导,质软、密度小、熔点低。
(2)钠与水反应:2Na+2H2O=2NaOH+H2↑
(3)钠保存在煤油中,空气中的变化过程:最终变为Na2CO3☆☆☆☆☆
Na → Na2O →NaOH → Na2CO3·12H2O →Na2CO3
(4)碳酸钠与碳酸氢钠的性质比较:☆☆☆☆☆
|
名称 |
碳酸钠 |
碳酸氢钠 |
|
化学式 |
Na2CO3 |
NaHCO3 |
|
俗名 |
纯碱、苏打 |
小苏打 |
|
溶解性 |
|
溶解度比碳酸钠小 |
|
热稳定性 |
--- |
2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
|
与盐酸反应 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
比Na2CO3剧烈NaHCO3+HCl=NaCl+H2O+CO2↑ |
|
与NaOH反应 |
--- |
NaHCO3+NaOH=Na2CO3+H2O |
|
相互转化 |
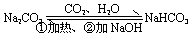 |
①除杂:Na2CO3固体(混有少量NaHCO3)-----充分 加热
Na2CO3溶液(混有少量NaHCO3)-----加适量NaOH溶液
②鉴别碳酸钠和碳酸氢钠两种物质的方法:
固体:加热有气体出现的是碳酸氢钠;溶液:加氯化钙溶液有沉淀的是碳酸钠
(五)原子结构与元素周期律
1、原子结构
 质子 Z
质子 Z
 原子核
原子核
(1)原子 AZX 中子 N= A-Z
核外电子 Z
(2)质量数=质子数+中子数。
(3)核电荷数=质子数=原子核外电子数=原子序数。
(4)同位素:有相同质子数不同中子数的不同原子互称。
例:氕11H、氘21H(重氢)、氚31H(超重氢)。重氢、超重氢常用于制造氢弹。
2、核外电子排布
(1)原子核外电子是分层排布的,称电子层。电子层数=元素周期数。
(2)原子核外电子排布是能量高低从里到外从低到高分层依次排布的。
(3)熟练掌握1-20元素的核外电子排布情况及原子结构示意图。
3、元素周期律和元素周期表
(1)元素周期律:每一周期从左向右,原子半径逐渐减小;主要化合价从 +1-+7(F、O无正价),金属性逐渐减弱,非金属性逐渐增强。
每一主族从上到下右,原子半径逐渐增大;金属性逐渐增强,非金属性逐渐减弱。
(2)元素周期表。用一句话来概括元素周期表的结构:三短三长一不完全;七主七副Ⅷ和零。
(3)金属性、非金属性强弱判断方法:☆☆☆☆☆
①元素的金属性越强△与水反应越容易△与酸反应越容易△最高价氧化物对应的水化物(氢氧化物)碱性越强△能把相对不活泼的金属从其盐溶液中置换出来。
金属性:Na>Mg>Al;
氢氧化物碱性强弱:NaOH > Mg(OH)2> Al(OH)3
(NaOH强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物)
②元素的非金属性越强△越容易形成气态氢化物△气态氢化物稳定性越好△最高价氧化物对应的水化物(含氧酸)酸性越强△能把相对不活泼的非金属从其化合物中置换出来。
非金属性:Si <P< S< Cl;
酸性强弱:H3PO4 <H2SO4<HClO4;
(H3PO4是中强酸,H2SO4是强酸, HClO4是最强酸)
氢化物的稳定性:SiH4<PH3<H2S<HCl
(元素的非金属性越强,形成的氢化物越稳定)
(4)熟练掌握常见10电子,了解18常见电子微粒。☆☆☆☆☆
①常见的10电子微粒中,分子有:Ne、CH4、NH3、H2O。
阳离子有:Na+ 、Mg2+ 、Al3+、NH4+ 、H3O+。
阴离子有:F-、O2-、N3-、OH-
②常见的18电子微粒中,分子有:H2S 、HCl、H2O2 、C2H6(略讲)
阳离子有:K+、Ca2+ 阴离子有:S2-、Cl-
4、化学键
(1)化学键可分为离子键和共价键,共价键可分为极性键和非极性键。
(3)常见电子式的书写☆☆☆☆☆
①写出下列物质的电子式:H2 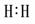 Cl2
Cl2 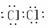 N2
N2 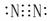 HCl
HCl 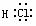 H2O
H2O CO2
CO2 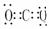 NH3
NH3 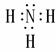 CH4
CH4
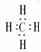
NaCl 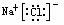 MgCl2
MgCl2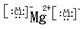 NaOH Na+
NaOH Na+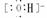
②用电子式表示下列物质的形成过程:
HCl : ;
H2O: ;
NaCl: ;
MgCl2: 。
(四)化学反应速率和化学限度
1、化学反应速率:常用单位时间内反应物浓度的减小或生成物浓度的增加来表示。
(1)各物质表示的速率比等于该反应方程式中相应的计量系数比。
(2)影响化学反应速率的因素
①内因:反应物的性质(主要)。
②外因:主要有浓度、温度、压强和催化剂等。其他如:反应接触面积的大小、固体反应物的颗粒大小、光照、超声波、电磁波、溶剂等对反应速率也有影响。
2、化学反应限度:
(1)化学反应限度的研究对象是可逆反应。
(2)化学反应限度也就是在一定条件下的可逆反应里,当正反应速率等于逆反应速率,反应物和生成物的浓度不再变化的状态。此时,化学反应达到最大限度。
(三)物质的量及其计算
1、了解物质的量、物质的摩尔质量、物质的微粒数、气体摩尔体积、阿伏加德罗定律、物质的量浓度等物理量的内涵,并能进行熟练计算。重点相关原子守恒计算。
2、阿伏加德罗常数,一般用NA表示,其数值约为6.02×1023mol-1。
阿伏加德罗常数计算中对错辨析举例:☆☆☆☆☆
(1)1mol/L Na2CO3溶液中所含Na+数为2NA (错,无溶液体积)
(2)常温常压下,3.2克O3所含的氧原子数为0.2NA (对)
(3)标准状况下, 2.24L苯所含分子数为0.1NA (错,S.P.T下苯为液体)
(4)标准状况下,2.24L Cl2完全溶于水转移电子数为0.1NA
(错,溶于水不等于与水完全反应)
(5)标准状况下,2.24L Cl2与氢氧化钠完全反应转移电子0.2NA (错,0.1NA )
(6)5.6g Fe与Cl2 完全反应,转移电子0.2NA (错,0.3NA )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com