
题目列表(包括答案和解析)
(六) 塑料、纤维和橡胶
1、通常所说的三大合成材料是指塑料、合成纤维和合成塑料。
2、塑料的主要成分是合成树脂,除此外还根据需要加入某些特定用途的添加剂,比如能提高塑性的增塑剂,防止塑料老化的抗老化剂等。
3、热塑性指的是塑料冷却后又变成固体,加热后又熔化,具有线性结构,常见的热塑性塑料有聚乙烯、聚氯乙烯(可用作视频、药物的包装袋)、聚丙烯。热固性指的是在制造过程中受热能变软,但加工成型后受热不能再软化,具有体型网状结构结构。
4、天然纤维如棉花、麻、蚕丝、羊毛等,而人造纤维如腈纶、涤纶、维纶、氯纶、丙纶、锦纶,称为“六大纶”。
5、天然橡胶的化学组成是聚异戊二烯,结构式是(略,重点),写出以异戊二烯为原料制备合成橡胶(异戊橡胶)的化学反应方程式(略,重点)。
6、合成橡胶分为通用橡胶和特种橡胶,常用的通用橡胶有氯丁橡胶、顺丁橡胶、丁苯橡胶等。特种橡胶有耐热和耐酸碱的氟橡胶,耐高温和耐严寒的硅橡胶等
7、许多橡胶是线性结构,可塑性好,但强度和韧性差,为了克服这个缺点,工业上常用硫与橡胶分子作用,使橡胶硫化,形成体型网状结构,使橡胶具有较高的强度、韧性、良好的弹性、化学稳定性。
8、复合材料指的是将两种或两种以上不同性能的材料组合起来的具有优良性能的材料。玻璃纤维增强塑料(玻璃钢)就是玻璃纤维和合成树脂组成的复合材料。将玻璃熔化并迅速拉成细丝得到异常柔软的玻璃纤维,然后将其加到合成树脂中就得到了玻璃钢。玻璃钢广泛用于汽车车身、火车车厢、船体以及印制电路板等
(五) 玻璃、陶瓷和水泥
1、普通玻璃是Na2SiO3、Ca2SiO3、SiO2熔化在一起得到的物质,主要成分是SiO2。这种物质称作玻璃态物质,没有一定的熔点,而是在某个范围内逐渐软化
2、在生产过程中加入不同的物质,调整玻璃的化学组成,可制成具有不同性能和用途的玻璃。如:提高SiO2的含量或加入B2O3能提高玻璃的化学稳定性和降低它的热膨胀系数,从而使其更耐高温和抗化学腐蚀,可用于制造高级的化学器皿;加入PbO后制得的光学玻璃折光率;加入某些金属氧化物可制成彩色玻璃:加入Co2O3玻璃呈蓝色,加入Cu2O玻璃呈红色,加入Fe2+玻璃呈绿色
3、制造陶瓷的主要原料是黏土(主要成分可表示为Al2O3.2SiO2.2H2O)。
4、以石灰石和黏土为主要原料,经研磨、混合后在水泥回转窑中煅烧,然后加入适量的石膏,并研成细粉就得到普通的硅酸盐水泥。这种水泥的主要成份是硅酸二钙2CaO·SiO2、硅酸三钙3CaO·SiO2、铝酸三钙3CaO·Al2O3 ,加入石膏的目的是为了延缓水泥的硬化。
5、水泥的吸水性很强,能吸收空气中的水份并与之发生化学反应,所以不能长期存放,即使短期存放也要注意防潮。一般水泥的保质期是三个月
6、水泥、砂子和水的混合物叫水泥砂浆,使建筑用黏合剂,可把砖、石等黏合起来。水泥、砂子和碎石的混合物叫做混凝土。
8、从高纯度的SiO2熔融体中,拉出直径约为100μm的细丝,就得到石英玻璃纤维,其传导光的能力非常强,所以又称光导纤维,简称光纤。
9、利用光缆通信,能同时传输大量信息。光缆的抗干扰能力好、通信质量高、能防窃听。光缆的质量小而且细,耐腐蚀,铺设也很方便,因此是非常好的通信材料。光导纤维除了可以用于通信外,还用于医疗、信息处理、传能传像、遥测遥控盒照明等许多方面。
10、随着科学技术的发展,人们研制出了许多有特殊功能的陶瓷,如超硬陶瓷、高温结构陶瓷、生物陶瓷、超导陶瓷等,使陶瓷的用途不断扩展
(四) 合金 金属的腐蚀和防护
1、合金是由两种或两种以上的金属(或金属和非金属)熔合而成的具有具有金属特性的物质,与各成分的金属相比,其特点为硬度比各组成成分大, 熔点比各组成成分低。
2、我们经常使用的合金有铁合金、铝合金、铜合金和新型合金。
3、生铁和钢是含碳量不同的的两种铁碳合金。
4、钢一般分为碳素钢和合金钢两大类。根据含碳量不同,前者可以分为高碳钢、中碳钢和低碳钢。含碳量高,硬度大,韧性差、延展性差,含碳量低,硬度小,韧性好、延展性好。后者最常见的一种是不锈钢,其合金元素主要是Cr和Ni,它在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力;但不锈钢的不锈是相对的,在海水中会被腐蚀。
5、Al是地壳中含量最多的金属元素,纯铝的硬度和强度较小,不适于制造机器零件
6、常见的铜合金有黄铜(Cu-Zn合金,含Zn20%~36%)和青铜(Cu-Sn合金,含Sn10%~30%)
7、金属的腐蚀是指金属或者合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程,其本质是M-ne-=Mn+。一般可以分为化学腐蚀和电化学腐蚀,前者指的是金属跟接触到的气体或液体直接发生氧化还原反应而被腐蚀的过程,后者指的是不纯的金属或合金跟接触到的气体或液体发生的间接氧化还原反应的过程,一般情况下,着两种腐蚀同时存在,只是电化学腐蚀比化学腐蚀要普遍得多。
8、以不纯的钢铁为例分析钢铁的腐蚀情况:
①吸氧腐蚀的实质是铁在电解质的存在下被O2氧化,这一腐蚀过程因吸收了氧气而被称为吸氧腐蚀。发生吸氧腐蚀的条件是中性或弱酸性环境,正极反应是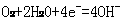 ,负极反应是
,负极反应是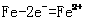 ②析氢腐蚀条件是强酸性环境,正极反应是
②析氢腐蚀条件是强酸性环境,正极反应是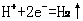 ,负极反应是
,负极反应是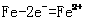
9、影响金属腐蚀的因素包括金属本性和外部介质两个方面。就前者而言,金属越活泼,就越容易被腐蚀;后者包括温度、反应物浓度、接触面积、环境湿度等方面
10、防止金属腐蚀的方法有改变金属内部结构、外加保护膜、电化学保护法。
(三) 正确使用药物
1、人工合成药物主要有解热镇痛药、抗生素和抗酸药等
2、阿司匹林是人们熟知的治感冒药,具有解热镇痛的作用,其化学名是乙酰水杨酸,是第一个重要的人工合成药物,结构式为(略,重点)。阿司匹林是一种有机酸,白色晶体,难于水以水杨酸为原料,使之与乙酸酐直接反应制备阿司匹林的化学反应方程式为: (参照教材,重点);可溶性阿司匹林的疗效更好,写出制备的化学反应方程式: (参照教材,重点)。但长期大量服用阿司匹林会有不良反应如水杨酸反应、胃肠道反应,出现水杨酸反应这种情况是中毒的表现,应立即停药并静脉滴注NaHCO3溶液
3、青霉素是重要的抗生素即消炎药,有阻止多种细菌生长的优异功能,在使用之前要进行皮肤敏感性试验(简称“皮试”),以防止过敏反应的发生
4、抗酸药作用是中和胃酸,缓解胃部不适,其主要成分时能中和盐酸的化学物质,如 氢氧化铝、碳酸氢钠、碳酸镁、氢氧化镁、碳酸钙等。
5、天然药物麻黄碱具有止咳平喘的作用,但服用麻黄碱有时会出现中枢兴奋所导致的不安、失眠等,晚间服用最好同服镇静催眠药以防止失眠,运动员不能服用麻黄碱。
(二)合理选择饮食
1、水是人体的重要组成成分,约占人体体重的三分之二,其主要作用是良好溶剂、反应介质和反应物、调节体温。
2、食物的酸碱性与化学上所指的溶液的酸碱性不相同,他是指食物的成酸性或成碱性,是按食物在体内代谢的最终产物的性质来分类的。例如,由C、N、S、P等元素组成的蛋白质,在体内经过消化、吸收后,最后氧化成对应的的酸:C变成碳酸,N变成尿酸,S变成硫酸,P变成磷酸,这些最终产物是酸,使体液呈弱酸性。又如某些蔬菜、水果多含K、Na、Ca、Mg等盐类,在人体内代谢后生成碱,使体液呈弱碱性。而人体血液的pH总保持碱性环境(7.35-7.45)。
3、常见的食品添加剂的分类为着色剂、防腐剂、调味剂、营养添加剂。着色剂主要包括:胡萝卜素、胭脂红、苋菜红、柠檬黄。早期采用的防腐剂主要是食盐、食醋、糖等,现在常用的防腐剂有苯甲酸钠、硝酸盐、亚硝酸盐、二氧化硫。 调味剂主要有:食盐、食醋、味精。营养强化剂加碘食盐、铁强化酱油……
(一)维生素和微量元素
1、维生素是参与生物生长发育和新陈代谢所必需的一类小分子有机化合物,习惯上按照不同的溶解性,把它们分为脂溶性维生素(主要包括维生素A、D、E、K)和水溶性维生素(主要包括维生素C、维生素B族)
2、维生素C是一种无色晶体,是一种水溶性维生素,溶液显酸性,其广泛存在于新鲜水果和绿色蔬菜中,人体不能合成,必须从食物中补充。维生素C也称抗坏血酸,在人体内有重要的功能。维生素C的化学特性是容易失去电子,是一种较强的还原剂,在水中或受热时很溶液被氧化,在碱性溶液中更容易被氧化。因此,生吃新鲜蔬菜比熟吃时维生素C损失小
3、人体中微量元素含量极少,质量不到体重的万分之一,如Fe、I、Se等共16种,而常量元素是指含量在0.01%以上的元素,如C、H、O等共11种
4、碘是人体必需的微量元素之一,有智力元素之称。碘在人体内的含量仅约为30mg,其中一半集中在甲状腺内,其余则分布在其他组织。可多吃海带、海鱼、紫菜来补充;也可吃加碘食盐(含有KIO3),但在食用时要注意:存放时密封、防潮、防晒,菜出锅时再放以防分解
5、铁在人体中的含量约为4-5g,是人体必需的微量元素中最多的一种。人体内的含铁化合物主要分为两类,即功能性铁和储存性铁,它们一起参与O2的运输,缺铁可通过铁强化酱油来补充,之所以选用酱油作为铁强化食物的载体,这主要是因为酱油可以促进铁吸收,而且具有广泛的群众食用基础,另外,人们对酱油的日摄入量稳定在相对合理的数值范围内
6、中国有句名言:药补不如食补。人体有自我调节能力,只要养成科学的饮食习惯、不偏食、不挑食、全面摄取各种营养,保持膳食平衡,食物中所提供的维生素和微量元素就足够了
(四)典型有机物及其反应:
1、化石燃料: 煤、石油、天然气
2、甲烷
(1)结构:分子式:CH4 结构式:
(2)电子式 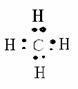
(3)空间构形:正四面体
(4)甲烷存在:天然气、沼气、瓦斯、坑气等的主要成分都为CH4
(5)饱和烃,化学性质稳定,光照下能发生取代反应,不能使溴的CCl4溶液或酸性KMnO4溶液褪色。燃烧火焰淡蓝色(类同H2),点燃前必须检验其纯度(类同H2)。
3、乙烯(乙炔)
(1)结构:乙烯分子式:C2H4 结构简式:CH2=CH2 结构式
6个原子在同一平面上。乙炔4个原子在同一直线上。
(2)化学性质:
①可燃性:CH2=CH2+3O2 2CO2+2H2O
2CO2+2H2O
现象:火焰较明亮,有黑烟(含碳量高)。
②加成、加聚反应,都能使溴的CCl4溶液或酸性KMnO4溶液褪色。
(3)用途:①石油化工基础原料 (乙烯的产量是衡量一个国家石油化学工业的重要标志);②植物生长调节剂、催熟剂。
4、苯
(1)结构:没有真正意义上的双键,而是介于单键和双键之间的一种独特的键。
(2)化学性质:“易取代、难加成、难氧化”。 性质稳定,不能酸性KMnO4溶液褪色。
(苯能使溴水褪色,但不是化学变化,是萃取。用酸性KMnO4溶液可鉴别苯及其同系物。)
①苯与液溴反应(需铁作催化剂):(取代反应)
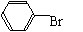

 + Br2 + HBr
+ Br2 + HBr
②苯的硝化反应:(取代反应)
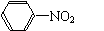
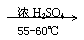
 + HNO3
+H2O
+ HNO3
+H2O
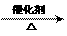
 ③苯与氢气加成生成环己烷:
+ 3H2
③苯与氢气加成生成环己烷:
+ 3H2 
5、乙醇
(1)结构:结构简式:CH3CH2OH 官能团:醇-OH
(2)化学性质:
①可燃性:CH3CH2OH+3O2 2CO2+3H2O
2CO2+3H2O
②催化氧化;2CH3CH2OH+O2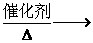 2CH3CHO+2H2O
2CH3CHO+2H2O
③与钠反应:2CH3CH2OH+2Na 2CH3CH2ONa+H2↑
2CH3CH2ONa+H2↑
(3)用途:燃料、溶剂、原料,75%(体积分数)的酒精是消毒剂。
6、乙酸
(1)结构:结构简式:CH3COOH
(2)化学性质:
①酸性:CH3COOH CH3COO-+H+ 酸性:CH3COOH>H2CO3
CH3COO-+H+ 酸性:CH3COOH>H2CO3
2CH3COOH+Na2CO3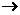 2CH3COONa+H2O+CO2↑
2CH3COONa+H2O+CO2↑
②酯化反应:醇和酸起作用生成酯和水的反应叫酯化反应。注意这一个实验内容和装置。
CH3CH2OH+CH3COOH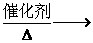
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
反应类型:取代反应 反应实质:酸脱羟基醇脱氢
浓硫酸:催化剂 和吸水剂
饱和碳酸钠溶液的作用:△中和挥发出来的乙酸(便于闻乙酸乙脂的气味)△吸收挥发出来的乙醇△降低乙酸乙脂的溶解度。即可用“除、溶、降”三个字来概括。
7、油脂
 油:植物油 (液态)不饱和高级脂肪酸的甘油酯;
油:植物油 (液态)不饱和高级脂肪酸的甘油酯;
(1)分类:油脂
脂:动物脂肪(固态)饱和高级脂肪酸的甘油酯。
(2)用途:(1)食用(2)制肥皂、甘油、人造奶油、脂肪酸等。
8、糖类
(1)分类
 单糖:葡萄糖C6H12O6
单糖:葡萄糖C6H12O6
糖类 二糖:蔗糖:C12H22O11
多糖:淀粉、纤维素(C6H10O5)n
(2)葡萄糖:结构简式CH2OH─CHOH─CHOH─CHOH─CHOH─CHO
△氧化反应
葡萄糖能发生银镜反应 (光亮的银镜) 与新制Cu(OH)2反应 (红色沉淀)
证明葡萄糖的存在 检验病人的尿液中葡萄糖的含量是否偏高
△人体组织中的氧化反应 提供生命活动所需要的能量
(3)淀粉
△水解
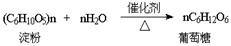
△颜色反应:与碘单质作用显蓝色
9、蛋白质
(1)组成元素:C、H、O、N等,有的有S、P
(2)性质
①蛋白质是高分子化合物,相对分子质量很大。
②盐析:蛋白质溶液中加入浓的无机盐溶液,使蛋白质的溶解度降低从而析出。
(用反复盐析的方法可分离提纯蛋白质。)
③变性:蛋白质发生化学变化凝聚成固态物质而析出。
④鉴别:蛋白质灼烧发出烧焦羽毛的特殊气味。
⑤蛋白质水解生成氨基酸
 蛋白质
氨基酸
蛋白质
氨基酸
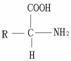
氨基酸的结构通式:
10、四大天然有机高分子物质:淀粉、纤维素、蛋白质和天然橡胶。☆☆☆☆☆
(三)同分异构现象:
同分异构体:分子式相同结构式不同的化合物互称。注意常见物质名称。
1、C4H10 CH3CH2CH2CH3 CH3CHCH3
正丁烷
CH3
异丁烷
CH3
2、C5H12 CH3CH2CH2 CH2 CH3 CH3CHCH2 CH2 CH3C CH3
戊烷
CH3 CH3
2-甲基丁烷 2,2-二甲基丙烷
(二)常见有机反应:
1、取代反应:CH4+Cl2 CH3Cl+HCl CH3Cl+Cl2
CH3Cl+HCl CH3Cl+Cl2 CH2Cl2+ HCl
CH2Cl2+ HCl
CH2Cl2+Cl2 CHCl3+ HCl
CHCl3+Cl2
CHCl3+ HCl
CHCl3+Cl2 CCl4+ HCl
CCl4+ HCl
2、加成反应: CH2=CH2+H2O CH3CH2OH CH2=CH2+Br2→CH2BrCH2Br
CH3CH2OH CH2=CH2+Br2→CH2BrCH2Br
3、 加聚反应:
加聚反应:
4、氧化反应: 2CH3CH2OH+O2  2CH3CHO+2H2O
2CH3CHO+2H2O
5、酯化反应: CH3CH2OH+CH3COOH
 CH3COOCH2CH3+H2O (实质取代反应)
CH3COOCH2CH3+H2O (实质取代反应)
(一)重要转化关系:☆☆☆☆☆
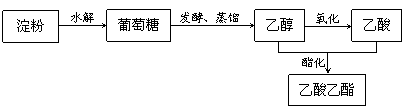
1、以淀粉为原料可制取香料乙酸乙酯,生产流程为:
2、自然界中的碳循环:
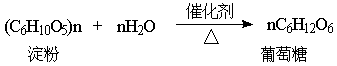
C6H12O6+6O2→6CO2+6H2O
(人体组织中的氧化反应,提供生命活动所需要的能量。)
C6H12O6 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
CH3CH2OH+3O2 2CO2+3H2O 乙醇是可再生性绿色能源。
2CO2+3H2O 乙醇是可再生性绿色能源。
6CO2+6H2O→ (光照,叶绿素)C6H12O6+6O2
nC6H12O6(葡萄糖)→(C6H10O5)n(淀粉)+nH2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com