
题目列表(包括答案和解析)
4.下列关于有机物的说法中,正确的一组是
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油中加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液
④石油的分馏和煤的气化都是发生了化学变化
⑤淀粉遇碘酒变蓝色,在加热条件下葡萄糖能与新制Cu(OH)2悬浊液发生反应
A.①②⑤ B.①②④ C.①③⑤ D.③④⑤
3.分类是学习和研究化学的一种常用的科学方法。下列分类合理的
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④根据反应的热效应将化学反应分为放热反应和吸热反应
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
2.以下关于锂、钠、钾、铷、铯的叙述错误的是
①氢氧化物中碱性最强的是CsOH ②单质熔点最高的是铯
③它们都是热和电的良导体 ④它们的密度依次增大,均要保存在煤油中
⑤它们的还原性依次增强 ⑥它们对应离子的氧化性也依次增强
A.①③ B.②⑤ C.②④⑥ D.①③⑤
1.第十八届“世界水日”的主题是“关注水质、抓住机遇、应对挑战”。下列说法错误的是
A.推广使用无磷洗衣粉主要是为了防止水体富营养化
B.日常生活中,常用加热煮沸的方法来降低硬水的硬度(即Ca2+、Mg2+的含量)
C.利用ClO2对自来水消毒主要是因为ClO2具有强氧化性,能杀死水中的病菌
D.回收废旧电池主要是防止电池中的NH4Cl对水资源造成污染
22、(14分)已知: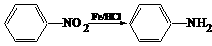 (苯胺,易被氧化)。甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物。以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下。
(苯胺,易被氧化)。甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物。以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下。
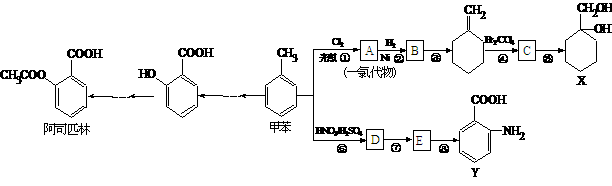 请回答下列问题:
请回答下列问题:
(1)甲苯的1H核磁共振谱图中有 个特征峰。
(2)中间产物D与目标产物Y的关系是 。
(3)写出结构简式:A ,E 。
(4)写出所加试剂或反应条件:反应⑤ 。
(5)写出反应③的化学方程式:
。
(6)写出阿司匹林与足量的NaOH(aq)反应的化学方程式:
。
21、(9分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
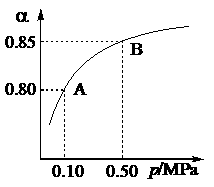
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
 (3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
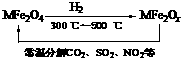
请写出MFe2Ox分解SO2的化学方程式______________________________________(可不配平)。
20、(11分)照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(已知:4H++2 [Ag(S2O3)2]3- = Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
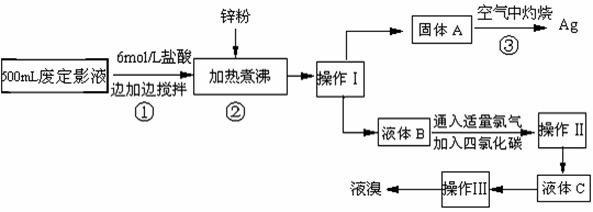
⑴操作Ⅲ的名称是 ;操作Ⅱ需要的主要玻璃仪器有 。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为 。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是 。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是 。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为 。
19、(12分)四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管中出现红褐色。向其中再滴入稀硫酸,红褐色变为黄色。请用化学方程式或离子方程式①、②、③中加点的字。
① ② ③ 。
18、一定量的Fe和Fe2O3混合物投入2 mol/L 250ml的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1 mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.450ml B.500ml C.400ml D.无法确定
17、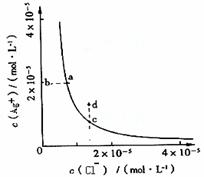 某温度时,AgCl
(s)
某温度时,AgCl
(s) Ag+(aq)+Cl-(aq)在水中的沉淀溶解
Ag+(aq)+Cl-(aq)在水中的沉淀溶解
平衡曲线如图所示。下列说法正确的是 ( )
A.加入AgNO3可以使溶液由c点变到d点
B.加入固体NaCl则AgCl的溶解度减小,Ksp也减小
C.d点有AgCl沉淀生成
D.c点对应的Ksp小于a点对应的Ksp
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com