
题目列表(包括答案和解析)
3.当光束通过下列分散系:①尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到有丁达尔现象的是( )
A.①② B.②③ C.①④ D.②④
2.赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是( )
A.硫酸 B.烧碱 C.盐酸 D.氢氟酸
1.下列物质中,不属于合金的是( )
A.硬铝 B. 水银 C. 黄铜 D. 钢铁
30、[有机化学基础](9分)
用芳香烃A为原料合成G的路线如下:
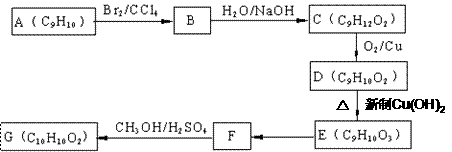
其中D分子苯环上只有一个支链,该分子在光照条件下与Cl2 发生取代反应生成的一氯代物只有一种,D与新制备的Cu(OH)2 悬浊液反应生成红色沉淀。
(1)化合物 D的结构简式为 ,
化合物E中的官能团有 (填名称);
(2)①B→C的反应类型是 ,
②F→G的化学方程式为 ;
(3)写出符合下列条件的F的同分异构体的结构简式 ;
①分子内含苯环,且苯环上只有一个支链;
②一定条件下,1 mol该物质与足量银氨溶液充分反应,生成4 mol银单质。
2011年三明市区高三毕业班联考试卷
30、[物质结构与性质](9分)
(1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与 个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为 。
(2)A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
①当n=2时,AB2属于__ ____分子(填“极性”或“非极性”)。
 ②若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_________
(用元素符号表示)
②若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_________
(用元素符号表示)
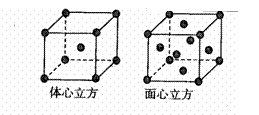 (3)CaO晶胞如右图所示其中Ca2+的配位数为
,CaO晶体和NaCl晶体的离子排布方式相同,CaO晶体的熔点高于NaCl晶体的熔点的主要原因是
。
(3)CaO晶胞如右图所示其中Ca2+的配位数为
,CaO晶体和NaCl晶体的离子排布方式相同,CaO晶体的熔点高于NaCl晶体的熔点的主要原因是
。
29、(8分)某同学设计下图装置进行铁和浓H2SO4反应的实验探究,请回答下列问题。
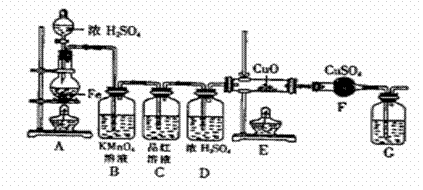
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是 。随后点燃A处酒精灯,就有气体产生了。
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:
________ _ ______,C中品红溶液颜色始终没有变化。
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是
.
(4)反应一段时间后,E、F处可观察到明显的现象, F处的实验现象是 .
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是______ _____
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
28、(8分)高岭土化学组成为:Al2O3(25%-34%)、SiO2(40%-50%)、Fe2O3(0.5%-3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:
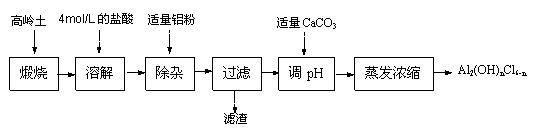
根据流程图回答下列问题:
(1)“煅烧”的目的是_________________________________________________。
(2)实验室配制4mol/L的盐酸100mL需要36.5%的浓盐酸(密度约为1.2g/cm3)约__ _____mL,配制用到的仪器有烧杯、玻璃棒、量筒、100mL容量瓶、 。
(3)任写一个 “溶解”过程中反应的离子方程式 ________ __。
(4)加适量铝粉的主要作用是_____________________________________。
(5)“蒸发浓缩”需保持温度在90-100℃,可采用的加热方法是 。
27、(11分)运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出往84消毒液中通入二氧化碳发生反应的离子方程式 。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
|
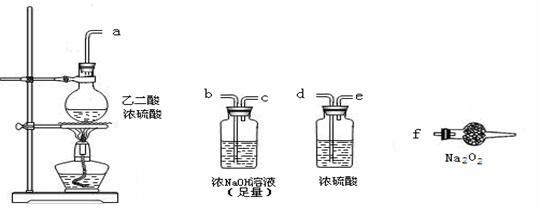
已知:H2C2O4====== CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为 ;
若CO能够与Na2O2发生反应,则预测反应产物为 。实验后用球形干燥管中的固体进行产物验证可选择的试剂是 。
(4)已知①C(s)+ O2(g)=CO2(g),△H=-393.5 kJ·mol -1 ;
②CO(g)+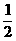 O2(g)=CO2(g),△H=-283.0 kJ·mol -1,
O2(g)=CO2(g),△H=-283.0 kJ·mol -1,
写出CO2 和C(s)反应的热化学方程式 ;
(5)以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸钠,工作时负极反应式为 ,若使用该电池电解饱和食盐水制取1molNaOH,则理论上需要氧气的体积为(标准状况下) L。
26、(8分)(1)已知:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 .
A.低温高压 B.加入催化剂 C.体积不变充入氦气 D.增加CO的浓度 E.分离出二甲醚
(2) 已知反应2CH3OH(g)
 CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.01 |
0.2 |
0.2 |
①该反应的平衡表达式K= ,该温度的平衡常数为 。
② 若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH) = 。
若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:
v正 v逆 (填“>”、“<”或“=”)。
25、(8分)短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物
C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激
性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中
长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素的原子结构示意图为 。
(2)B与氢氧化钠溶液反应的化学方程式为:
。
(3)G与氯酸钾在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为
,当生成2 二氧化氯时,转移电子
二氧化氯时,转移电子
 。
。
(4)H的化学式为 ,请预测一下往H溶液中滴入稀硫酸的反应现象为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com