
题目列表(包括答案和解析)
3.下列叙述正确的是 ( )
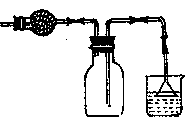 A.①分液,②过滤,③分馏,④重结晶都是混合物
A.①分液,②过滤,③分馏,④重结晶都是混合物
分离常用方法,其中根据粒子大小分离的只有②
B.欲配制质量分数10%的硫酸铜溶液,可准确称取
10g硫酸铜晶体溶于90g水中
C.中和滴定时,滴定前滴定管必须洗净并烘干
D.可用右图装置干燥、贮存并吸收多余的HCl气体
2.通过复习总结下列归纳正确的是 ( )
A.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
B.简单非金属阴离子只有还原性,丽金属阳离子不一定只有氧化性
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂与生成,也没有能量变化
1.化学在生产和日常生活中有着重要的应用。下列说法不正确的是 ( )
A.电解MgCl2饱和溶液,可制得金属镁
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.明矾水解形成的Al( OH)3胶体能吸附水中悬浮物,可用于水的净化
向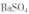 沉淀中加入饱和
沉淀中加入饱和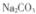 溶液,充分揽拌,弃去上层清液。如此处理多次,直到
溶液,充分揽拌,弃去上层清液。如此处理多次,直到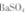 全部转化为
全部转化为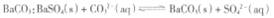 (已知该温度下的平衡常数K =0.042)
(已知该温度下的平衡常数K =0.042)
(3) 现有0.20 mol BaSO4,每次用1.00L 2.0mol.L-1饱和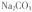 溶液处理,假定
溶液处理,假定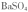 能全部转化,至少需要处理多少次?(写出计算过程)
能全部转化,至少需要处理多少次?(写出计算过程)



(1) 煅烧还原的热化学方程式为:____________________________________
有关的数据: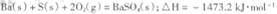
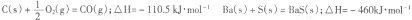
(2) 经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)___________________________
24.甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+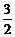 O2(g)
== CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)
== CO2(g)+2H2O(l)。其工作原理示意图如下:

|
|||
|
|||
甲 乙
请回答下列问题:
(1)写出甲图中b、c两个入口通入的物质名称(或化学式)b ▲ c ▲
(2)负极的电极反应式为 ▲ 。
(3)用该原电池电解AgNO3溶液,若Fe电极增重5.4g,则燃料电池在理论上消耗的氧气的体积为 ▲ mL(标准状况)
宁波市2010学年度第一学期期末试卷
23.某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案--气体分析法。

|
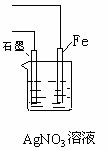
(1)甲同学用图1所示装置,把Xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是 ▲ 。
(2)乙同学用图2代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于 ▲ 、 ▲ 仪器中(填仪器编号);
G管可以用化学实验室里的一种常用仪器来替代,你认为这种仪器的名称是 ▲ ;仪器甲、乙接口的连接方式如下:A连接 ▲ ,B连接 ▲ ,C连接 ▲ ;(填写各
接口的编号)
(3)丙同学用图3装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 ▲ ;
使测定结果可能偏小的主要原因 ▲ ;
(上述偏大、偏小的原因各写一条)
21.(15分)元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):
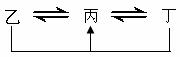
其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式: ▲ 。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式 ▲ ;
写出均含有F元素的乙与丁在溶液中发生反应的离子方程式 ▲ 。
(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是: ▲ 。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式 ▲ 。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式 ▲ ,析出该复盐晶体的原理是 ▲ 。
 22.(8分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
22.(8分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在FeCl2 ▲ (填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 ▲ (填“是”或“否”),
你的判断依据是 ▲ 。 ⑶请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
▲
⑷把AlCl3溶液加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体。 ▲
20.(12分)对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行
综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
(1)关于反应物之间的定量关系的研究:
已知反应:Br2+2Fe2+== 2Br-+2Fe3+ ,向10 mL 0.1 mol·L–1的FeBr2溶液中通入0.001 mol Cl2,该反应的离子方程式为: ▲
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)= ▲ 。
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气,发生反应:
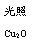
2H2O(g)  2H2(g)+O2(g) △H=+484 kJ·mol-1
2H2(g)+O2(g) △H=+484 kJ·mol-1
不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则前20 min的反应速率 v(H2O)= ▲ ;
达平衡时,至少需要吸收的光能为 ▲ kJ。
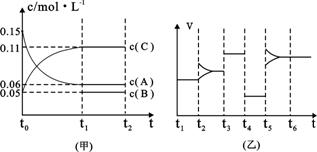 ③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出]。请回答:
③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出]。请回答:
I:t4-t5阶段改变的条件为 ▲ ,
II:B的起始物质的量为 ▲ 。
19.(4分)一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、
NO3-、SO42-、HSO3-、HCO3-和Cl-,取该溶液进行如下实验:
①将溶液滴在pH试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体遇空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是 ▲ ;肯定存在的离子是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com