
题目列表(包括答案和解析)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
C |
D |
A |
A |
A |
B |
C |
B |
B |
C |
C |
C |
C |
B |
D |
16.(12分)(1) 3NO2 +H2O=2HNO3+NO Cl2+H2O
+H2O=2HNO3+NO Cl2+H2O
 HCl+HClO 2Na2O2+2H2O=4NaOH+O2↑ (2) 2Na+2H2O=2NaOH+H2↑ 2F2+2H2O=4HF+ O2 Al2S3+6H2O=2AL(OH)3↓+3H2S↑( 每空2分, 其它合理答案均给分)
HCl+HClO 2Na2O2+2H2O=4NaOH+O2↑ (2) 2Na+2H2O=2NaOH+H2↑ 2F2+2H2O=4HF+ O2 Al2S3+6H2O=2AL(OH)3↓+3H2S↑( 每空2分, 其它合理答案均给分)
21、(选作二,每空2分,共12分)
乙炔是有机合成工业的一种原料,工业上曾用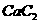 与水反应生成乙炔。
与水反应生成乙炔。
(1)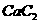 中
中 与
与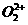 互为等电子体,
互为等电子体,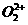 的电子式可表示为
;
的电子式可表示为
;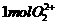 中含有的
中含有的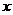 键数目为
。
键数目为
。
(2)将乙炔通入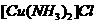 溶液生成
溶液生成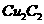 红综色沉淀。
红综色沉淀。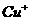 基态核外电子排布式为
。
基态核外电子排布式为
。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈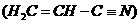 ,丙炔腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多的是
,丙炔腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多的是
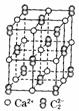
(4)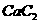 晶体的晶胞结构与
晶体的晶胞结构与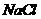 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但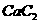 晶体中哑铃形
晶体中哑铃形 的存在,使晶胞沿一个方向拉长,
的存在,使晶胞沿一个方向拉长,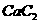 晶体中1个
晶体中1个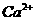 周围距离最近的
周围距离最近的 数目为
数目为
19.(7分)描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
|
酸或碱 |
电离常数(Ka或Kb) |
|
CH3COOH |
1.8×10-5 |
|
HNO2 |
4.6×10-4 |
|
HCN |
5×10-10 |
|
HClO |
3×10-8 |
|
NH3·H2O |
1.8×10-5 |
表1
|
难(微)溶物 |
溶度积常数(Ksp) |
|
BaSO4 |
1×10-10 |
|
BaCO3 |
2.6×10-9 |
|
CaSO4 |
7×10-5 |
|
CaCO3 |
5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”),理由是 ,
溶液中各离子浓度大小的关系是 。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上, 则溶液中CO32-物质的量浓度应≥ mol·L-1
(二选一。从20或21题中选择一题做到答题卷上,多选按第一题计分)
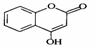
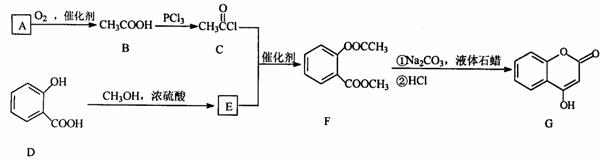 20(选作一,每空2分,共12分).
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
20(选作一,每空2分,共12分).
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
 请回答下列问题:
请回答下列问题:
 (1)A与银氨溶液反应有银镜生成,则A的结构简式是
。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是
。
 (2)B→C的反应类型是
。
(2)B→C的反应类型是
。
 (3)E的结构简式是
。
(3)E的结构简式是
。
 (4)写出F和过量NaOH溶液共热时反应的化学方程式:
(4)写出F和过量NaOH溶液共热时反应的化学方程式: 。
。
 (5)下列关于G的说法正确的是( )
(5)下列关于G的说法正确的是( )
 a.能与溴单质反应
b.能与金属钠反应
a.能与溴单质反应
b.能与金属钠反应
 c.1molG最多能和3mol氢气反应
d.分子式是C9H7O3
c.1molG最多能和3mol氢气反应
d.分子式是C9H7O3
(6)与D互为同分异构体且含苯环、属于酯类的有几种:

18.(10分)因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
 (1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1
mol水蒸气放热569.1 kJ。则该反应的热化学方程式为________________。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1
mol水蒸气放热569.1 kJ。则该反应的热化学方程式为________________。
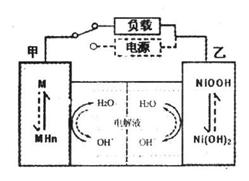
 (2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,
其总反应式是:
根据所给信息判断,混合动力车下 坡或刹车时,甲电极的电极反应式为_______;混合动力车上坡或加速时,乙电极的电极反应式为_________________。
坡或刹车时,甲电极的电极反应式为_______;混合动力车上坡或加速时,乙电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:CO(g)+1/2O2(g)  CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
|
容器编号 |
c(CO)/mo1·L-1 |
c (O2)/mol·L-1 |
c (CO2)/mol·L-1 |
v(正)和v (逆) 比较 |
|
I |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)=v(逆) |
|
Ⅱ |
3.0×10-4 |
4.0×10-4 |
8.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2 的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不
的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不 断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中CO的浓度为_________mol·L-1。
断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中CO的浓度为_________mol·L-1。
17.(14分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.0 0mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
0mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

A B C D E F G
(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
16.(12分)水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
A+H2O ;
B+H2O ;
C+H2O 。
(2)D、E、F是短周期元素组成的物质,D和水反应过程中,水是氧化剂,E和水反应过程中,水是还原剂,F和水发生复分解反应。请写出D、E、F与水反应的化学方程式:
D+H2O ;
E+H2O ;
F+H2O 。
15.各组物质不属于同分异构体的是 ( )
A.2,2-二甲基丙醇和2-甲基丁醇 B.邻氯甲苯和对氯甲苯
C.2-甲基丁烷和戊烷 D.甲基丙烯酸和甲酸丙酯
第Ⅱ卷 (非选择题 共55分)
14. 近年来,都市里的医疗美容机构数量日渐增多。由于各机构水平参差不齐和执业医生鱼龙混杂,医疗美容纠纷日益增多,不法分子把有毒的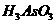 用作脱毛剂坑害顾客。在浓盐酸中,
用作脱毛剂坑害顾客。在浓盐酸中,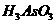 与
与 反应的离子方程式为:
反应的离子方程式为:
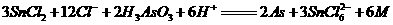 。关于该反应的说法中正确的组合是
(
)
。关于该反应的说法中正确的组合是
(
)
①氧化剂是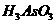 ;②还原性:
;②还原性: ;③每生成7.5gAs,还原剂失去的电子为0.3
;③每生成7.5gAs,还原剂失去的电子为0.3 ;④M为
;④M为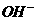 ;⑤
;⑤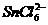 是氧化产物.
是氧化产物.
A.①②④⑤ B.①③⑤ C.①②③④ D.只有①③
13. 下列各表述与示意图一致的是 ( )
下列各表述与示意图一致的是 ( )
A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2
B.图①中使用的NaOH的浓度为2mol/L
C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低
D.图②中物质A反应生成物质C,△H>0;
12.下列选项错误的是 ( )
A.在NH4C1晶体中含有离子键和共价键
B.设想把“H2+Cl2=2HCl”设计成燃料电池,用于工业制盐酸,并进行发电
C.某反应△H>0,△S>0,该反应是个非自发反应
D.25℃时,NaNO2溶液的pH=8,c(Na+)-c(NO2-)=9.9×10-7mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com