
题目列表(包括答案和解析)
1.常温下,下列液体中pH>7的是 ( )
A.胃液 B.人体血液 C.橙汁 D.蔗糖水
24、(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:

(1)写出反应过程中的离子反应方程式:OC段 ,
DE段 ,
EF段_____________________________________。
(2)硝酸溶液的物质的量浓度为 mol·L-1
(3)B的值为_________mol,C的值为 mL。
23、(22分) A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 ,B元素形成的同素异形体的晶体类型可能是
。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。 FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为___________________________________。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为___________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)___________________________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%-30%的KOH溶液。则燃料电池放电时:正极的电极反应式是___________________________________。
(5)已知:2CD2(g)  C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
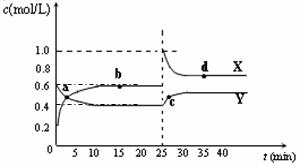
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
22、(8分) A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、SO42-、CO32-两两组合而成。为了确定这四种化合物的成份,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液 白色沉淀
白色沉淀 沉淀不溶解,
沉淀不溶解,
C溶液 白色沉淀
白色沉淀 沉淀不溶解,
沉淀不溶解,
D溶液 白色沉淀
白色沉淀 沉淀部分溶解。
沉淀部分溶解。
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
⑴请写出它们的化学式:A__________;B__________;C__________;D__________。
⑵上述②的第三次实验,加入A,产生白色沉淀的离子方程式为________________。
⑶③中若是向C溶液中滴入D溶液,可能出现的实验现象是_____________________。
.
21.(I)(6分)(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是________(填写编号)
①用pH试纸测定Na2CO3溶液的 pH ②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2 ·8H2O 晶体和NH4Cl 晶体反应过程中的能量变化
⑤实验室用新制的FeSO4 溶液和预处理过的NaOH 溶液制备Fe(OH)2 白色沉淀
(2)用“大于”、“小于”、或“等于”填空:
①读取量筒中液体体积时,视线偏高,读取的体积数________实际体积数
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量________10.4g。
③配制500mL0.1mol·L-1NaOH 溶液,定容时俯视刻度线,所得溶液的物质的量浓度_____________0.1mol·L-1
④用中和滴定测某NaOH 溶液的浓度,量取待测液时未用该溶液润洗滴定管,测得的溶液浓度___________实际浓度
(II).(10分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
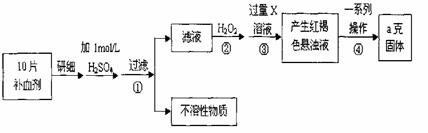
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含 mgFeSO4·7H2O的片剂。
20、m g FeO、Fe2O3、CuO的混合物,加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将m g的混合物用CO气体加热还原,实验过程中耗去标准状况下的CO3.36升,,得固体w g,w的值为 ( )
A. m-0.96 B.m-1.44 C.m-1.6 D.m-2.4
第II卷 非选择题(共58分)
19、向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是 ( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(H+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
18、X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是( )
 A.若W是单质铁,则Z溶液可能是FeCl2溶液
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是氢氧化钠,则X与Z可反应生成Y
C.若X是金属镁,则W可能是强氧化性的单质
D.若X氧气,则X、Z的相对分子质量可能相差4
17.某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0-t1阶段 c(B)未画出]。图乙为t2后改变互不相同的某一条件反应速率随时间变化的关系图,t3-t4阶段使用了催化剂。下列说法错误的是 ( )
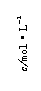

A.若 t1=15 s,生成物C在 t0-t1时间段的平均反应速率为 0.004mol·L-1·s-1
B.t4-t5阶段改变的条件为减小压强,t5-t6改变的条件是升高化学反应的温度
C.B的起始物质的量为0.02mol D.该化学反应的表达式为:3A  B + 2C
B + 2C
16、双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2yCO3,关于该物质的说法
正确的是 ( )
A.该物质属于两性氢氧化物 B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2yCO3最多可消耗3 mol H+ D.该药剂不适合于胃溃疡患者服用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com