
题目列表(包括答案和解析)
1.下列说法正确的是
A.酸雨形成的主要原因是汽车尾气的任意排放
B.填埋法是垃圾处理的最佳方法
C.维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好
D.淀粉、纤维素、蛋白质和油脂均属于天然高分子化合物
28. (16分)(1)三 (1分) ⅥA (1分) HClO4(1分)
(2) 非极性(1分) 2 (1分) H-Cl (1分) H-S(1分)
(3)1s22s22p63s23p63d104s1
(3分) 2Cu2S+3O2
 2Cu2O+2SO2(3分)
2Cu2O+2SO2(3分)
(4)2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=–270 kJ·molˉ1(3分)
26.(14分)
(1)①铁屑(1分) ②稀硫酸(1分)③稀硝酸(1分) ④氢氧化钠(1分)⑤氢氧化钠(1分)
(2)Fe+2H+=Fe2++H2↑(1分) 2Fe3++Fe=3Fe2+(1分)
Cu2++Fe=Cu+Fe2+(1分) 2Au3++3Fe=2Au+3Fe2+(1分)
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O (2分)
(3)Fe2O3 (1分) 用作红色涂料(1分) 用作制造铜盐的原料(1分)

28.(16分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级(即轨道)上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于周期表第__ __周期第_____族,Y和Z的最高价氧化物对应的水化物的酸性较强的是_______(写化学式)。
(2)XY2是一种常用的溶剂,XY2是__ _分子,该分子中存在__ _个σ键。在H-Y、H-Z两种共价键中,键的极性较强的是_________,键长较长的是______。
(3)W的基态原子核外电子排布式是_ _。W2Y在空气中煅烧生成W2O的化学方程式是_ __。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。已知: XO(g) +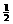 O2(g) = XO2(g) ΔH =–283.0
kJ·molˉ1
O2(g) = XO2(g) ΔH =–283.0
kJ·molˉ1
Y(s) + O2(g) = YO2(g) ΔH =–296.0 kJ·molˉ1
此反应的热化学方程式是_ __。

27、(14分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,选用酚酞为指示剂,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到
,则达到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的物质的量浓度: 。
|
滴定次数 |
待测液体积[来 (mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
(6)下列可能造成测定结果偏高的有 。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗酸式滴定管
26. (14分)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白:
(1)图中标号处需加入的相应物质分别是
① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;
写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
25.(8分)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X。 (1)根据题意,可判断出X是 (写化学式)。 (2)写出并配平该反应的化学方程式: ;
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 。
24.短周期元素E的氯化物ECl2的熔点为-78°,沸点为59°C,分子中各原子均满足8电子稳定结构,下列判断错误的是 ( )
A.E是一种非金属元素 B.在ECl2中E与Cl之间形成共价键
C.E的一种氧化物为EO2 D.E位于元素周期表的IVA族
第II卷(非选择题 共52分)
23.盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是( )
A.在Na2CO3溶液中加入与其溶质等物质的量的冰醋酸,溶液中存在:
c(Na+)
= c(CH3COOH) + c(CH3COO-)+ c(CO )+c(HCO
)+c(HCO ) + c(H2CO3)
) + c(H2CO3)
B.NaHCO3溶液中存在:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 1.0 mol·L-1CH3COOH溶液中加入0.01 mol的NaOH后,溶液中离子浓度的大小关系为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
D.相同条件下,中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量前者大
22.常温下,下列有关离子浓度及pH大小的比较,正确的是 ( )
A. NH4+ 浓度相同的下列溶液:①(NH4) 2 Fe(SO4)2 ②(NH4) 2 CO3 ③(NH4) 2SO4 ,
溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)> c(H+) > c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com