
题目列表(包括答案和解析)
1、下列离子方程式书写正确的是
A、金属钠加入水中:Na+H2O=Na++OH-+H2↑
B、氯气通入FeCl3溶液中:Fe2++Cl2=Fe3++Cl-
C、铜片加入稀硝酸中: 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D、小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
30.一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s) mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
试求:此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度。
衡阳市八中2011届高三第五次月考
29.(10分)某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。
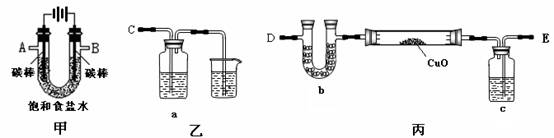
(1)为完成上述实验,正确的连接顺序为_______ 接A, B接_______(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为 。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液及对应的现象是
。
(4)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g, 放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g , 实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
① 请你分析并回答:你认为不合理的方案及其不足之处是
。
②按测得结果更准确的方案进行计算,Cu的相对原子质量 。
28.
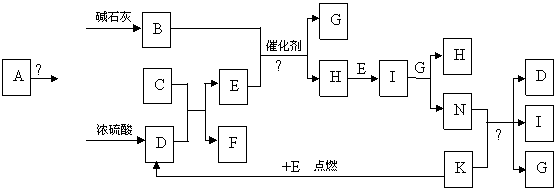 (10分)下图中的B-K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
(10分)下图中的B-K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
请回答下列问题:
(1) 写出实验室检验A物质中含有的阳离子的方法 。
(2) B与E反应得到1molH,则此时转移电子的物质的量为 mol。
(3) 写出实验室制取B的化学方程式 。
(4) 写出N的稀溶液与过量的铁粉反应的离子方程式 。
(5) 若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为 。
27.(10分)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为___________________________________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物的催化作用 D.反应物接触面积增大
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
|
温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请根据以下实验设计表将实验目的补充完整:
|
实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
|
① |
5 |
20 |
0 |
0 |
实验①和②探究 的影响;实验①和③探究 的影响。 |
|
② |
5 |
20 |
0.5 |
0 |
|
|
③ |
5 |
20 |
0 |
0.5 |
26.(8分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
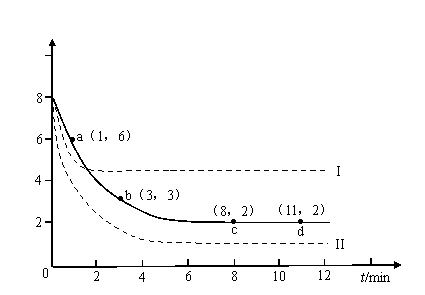

(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0-1min B.1-3min C.3-8min D.8-11min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
25.(8分)利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
(1)若烧瓶是干燥的,则由b口进气收集的气体有 (写序号);
(2)若烧瓶充满水,可收集的气体有 (写序号)。
(3) 若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有________,
这时气体由________口进入。
24.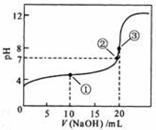 常温下,用 0.1000 mol·L
常温下,用 0.1000 mol·L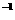 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L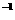 CH3COOH溶液所得滴定曲线如右图。下列说法正确的是
CH3COOH溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
 第Ⅱ卷 非选择题(共52分)
第Ⅱ卷 非选择题(共52分)
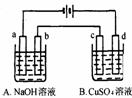
23.按右图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL
20%的NaOH溶液,B烧杯中装有500 mL pH为6的1 mol·L-1CuSO4
溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),
则B烧杯中溶液pH变为(溶液体积变化忽略不计)
A.4 B.3
C.2 D.1
22.反应CO(g)+H2O(g) 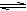 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
|
CO |
H2O |
CO2 |
H2 |
|
0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆)
 C.v(正)=v(逆)
D.无法判断
C.v(正)=v(逆)
D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com