
题目列表(包括答案和解析)
3.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.4.6g组成为C2H6O的有机物,所含C-H键数目一定为0.6NA
B.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
C.0.1molN2与0.3molH2在密闭容器中,在催化剂作用下充分反应,生成氨分子数为0.2NA
D.在反应5NH4NO3 2HNO3+4N2↑+9H2O中,每生成4molN2,转移电子数为15NA
2HNO3+4N2↑+9H2O中,每生成4molN2,转移电子数为15NA
2.下列有关表达不正确的是
A.具有16个质子、16个中子和18个电子的微粒是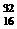 S
S
B.NH3的形成过程为: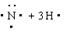


C.HCN的结构式为:H-C≡N
D.有机还原剂LiAlH4中,氢显-1价
1.在“十二五”期间,江苏省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.加大稀土资源的开采和出口,保证经济快速发展
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
19、(20分)
19-Ⅰ(6分)下列说法中,正确的是
A、熔点:MgO>NaCl>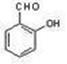 >
>
B、键角:CS2>SiF4>NH3>H2O
C、铬原子的价电子排布式为3d44s2
D、NH3比H2O更易与H+形成配位键,NH3比NF3更易与Cu2+形成配位键
19-Ⅱ(14分)铁元素的单质与化合物有广泛用途。请回答下列问题:
(1)铁元素在元素周期表的第四周期 族,属于 区元素。
(2)与Fe原子或离子形成配合物的分子或离子应具有的结构特征是 。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚等有机溶剂。三氯化铁晶体类型为 。
(4)Fe(CO)5具有相同化学键类型的化合物是
A、NH4Cl B、NaOH C、NH3-BF3 D[Cu(NH3)4]SO4
(5)六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是 。与CN-互为等电子体的单质分子含有σ键和Π键的数目分别为 。中心离子Fe2+的电子排布式为 。
(6)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。
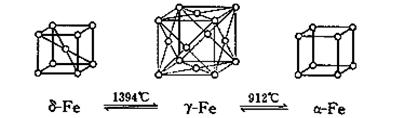
若在δ-Fe和γ-Fe两种晶体中最邻近的铁原子间距离相同,则两者密度之比为 。
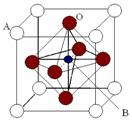 (7)某种钙钛型复合氧化物(如下图),这种化合物也具有巨磁电阻效应。
(7)某种钙钛型复合氧化物(如下图),这种化合物也具有巨磁电阻效应。
①这类特殊晶体的化学式为 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。则La1-xAxMnO3中三价锰与四价锰的物质的量之比为 。(用含x的代数式表示)
20(20分)
20-Ⅰ(6分)下列说法正确的是
A、在合成氨生产中,采用较高温度可以增大反应速率和提高混合物中氨的含量
B、氯碱生产的电解槽中隔膜的主要作用是允许离子和水通过,阻止两极电解产物混合
C、CaCl2属于“氨碱法”而不属于“联合制碱法”的副产品
D、具有永久硬度的水既可以用药剂法、离子交换法,也可以用加热的方法进行软化
20-Ⅱ(14分)
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:
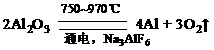
请回答下列问题:
(1)原料Al2O3能否用AlCl3代替? (填“能”或“不能”)。
(2)冰晶石(Na3AlF6)的作用是 。
(3)阴极和阳极均由 材料做成;电解过程中除定期补充Al2O3外,还需补充 (填“阳极”或“阴极”)材料,其原因是 。
(4)电解时,阴极反应式为 。
(5)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
18、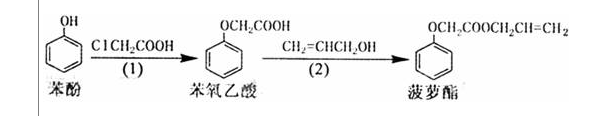 (20分)
(20分)
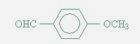
18-Ⅰ(6分)食品香精菠萝酯的生产路线(反应条件略去)如下:
下列叙述正确的是 A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验 B.步骤(2)产物中残留的烯丙醇可用酸性KMnO4溶液除去
C.步骤(1)(2)都是取代反应
D.苯酚、苯氧乙酸和菠萝酯均可与Na2CO3溶液反应 18-Ⅱ(14分)金属有机化合物广泛应用于有机合成,Grignard试剂是镁的一种金属有机化合物,它的合成方法是:
RX+Mg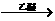 RMgX(Grignard试剂)
RMgX(Grignard试剂)
生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
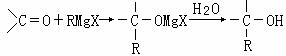
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成有机物I,合成线路如下:(提示:H的一氯代物只有3种。)
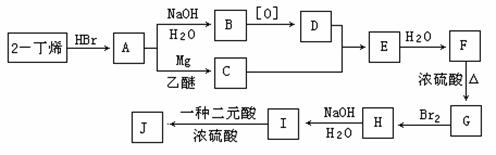
请按要求填空:
(1)3,4-二甲基-3-己醇的结构简式是 ;
(2)写结构简式:A 、G ;
(3)C+D→E的反应类型是 ,F→G的反应类型是 ;
(4)写出H→I化学反应方程式(有机物请用结构简式表示):
。
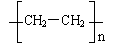
 (5)以乙烯和必要的无机物为原料合成2-丁醇。请写出合成路线(用合成路线流程图表示。)如
CH3CH2OH
(5)以乙烯和必要的无机物为原料合成2-丁醇。请写出合成路线(用合成路线流程图表示。)如
CH3CH2OH  CH2=CH2
CH2=CH2
17、(10分)乙二酸是一种重要的化工原料。
(1)乙二酸所含官能团的名称为 。乙二酸与乙二醇在一定条件下反应生成高聚物,此反应类型是 ,反应的化学方程式是 。(2)两个学习小组用如图装置探究乙二酸受热分解的部分产物。
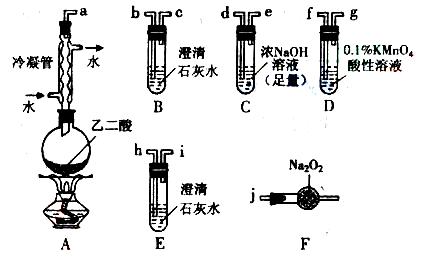
(1)甲组:
按接口顺序:a-b-c-d-e-f-g-h连接装置进行实验。B中溶液变浑浊,装置C的作用是 ;E中溶液变浑浊,D中的现象是 ,证明分解产物含有 。
(2)乙组:
从A-F中选用装置进行实验,证明甲组通入D的气体能否与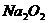 反应。
反应。
最简单的装置接口连接顺序是 ;实验后用F中的固体进行验证的方法是
(可另选试剂)。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
16、(8分)已知:R-CH-COOH+HNO2 → R-CH-COOH+N2+H2O
NH2 OH
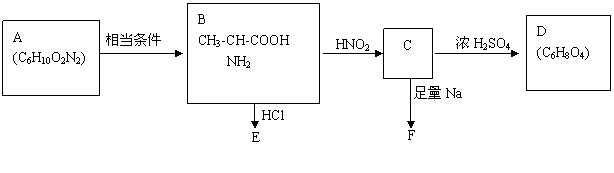 根据下图判断和回答问题:
根据下图判断和回答问题:
(1)B的名称为 。
(2)写出下列物质的结构简式:
A 、C 、D 、
E 、F 。
(3)C亦可由糖类中的物质W直接制取,W的结构简式为 。
(4)在核磁共振氢谱中D有 种氢原子。
15、(9分)下图每一方框中的字母代表一种反应物或生成物:
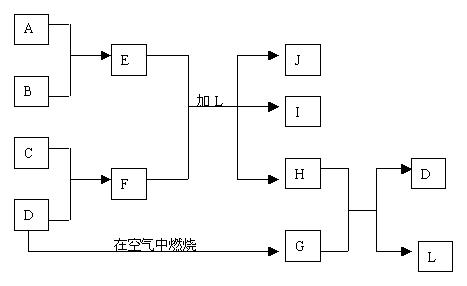
产物J是含A金属元素的胶状白色沉淀,能凝聚水中的悬浮物;I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为: 。
(2)F的水溶液呈 性(填“酸”“碱”或“中”),其原因(用离子方程式表示)是 。
(3)E、F在L中反应的离子方程式为 。
(4)H和G之间反应的化学方程式为: 。
(5)能用于测定空气中G含量的是 (填字母)
A、氨水、甲基橙试液 B、碘水、淀粉溶液
C、NaOH溶液、酚酞试液 D、KMnO4溶液、稀H2SO4

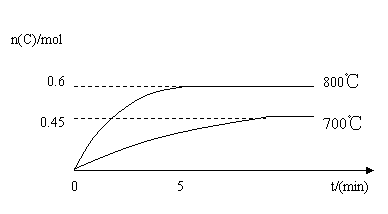 13(8分)在容积为2L的密闭容器中,进行反应:A(s)+2B(g)
C(g)+D(g)在不同温度下,C的物质的量n(C)和时间t的关系如图所示。试回答下列问题:
13(8分)在容积为2L的密闭容器中,进行反应:A(s)+2B(g)
C(g)+D(g)在不同温度下,C的物质的量n(C)和时间t的关系如图所示。试回答下列问题:
(1)800℃时,0-5min内,以B的浓度变化表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
a、容器中压强不变 b、混合气体中c(B)不变
c、2V正(B)=V逆(D) d、B、C、D的物质的量浓度比为2:1:1
e、容器中气体的密度不变
(3)若温度由800℃降至700℃,平衡常数K将 (填“增大”“减小”或“不变”),理由是 。
(4)若最初加入2.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K。(写出计算过程)
14、(8分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应。X元素在元素周期表中的位置是 。
(2)一定条件下,A和水缓慢作用生成含X元素的沉淀W和含Y的气态化合物Z,Z分子含有10个电子。
①往X的硫酸盐溶液中通入Z也有沉淀W析出。W的溶度积表达式KSP= 。
②Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为 。
③A的化学式是 。
(3)将X与Mg形成的合金投入浓NaOH溶液中发生剧烈的原电池反应,其负极反应方程式为 。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型材料,其反应的化学方程式是 。
12、水立方的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错误的是 A、ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的链节 B、聚全氟乙丙烯分子的结构简式可能为 [-CF2-CF2-CF2-CF-CF3-]n
C、六氟丙烯分子的所有原子在同一平面上 D、ETFE具有热塑性,能溶于适当溶剂
第Ⅱ卷(64分)
本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com