
题目列表(包括答案和解析)
1.2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料。下列说法不正确的是
A.钯催化剂能提高碳原子反应的活性
B.钯催化剂能催化所有类型的有机反应
C.“钯催化交叉偶联反应”有利于人类合成复杂分子
D.利用该技术能改变合成路径,降低反应发生的条件
21.(12分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)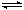 CH3OH(g)+H2O(g)
ΔH1
CH3OH(g)+H2O(g)
ΔH1
反应II:CO(g)+2H2(g) 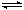 CH3OH(g)
ΔH2
CH3OH(g)
ΔH2
① 上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),
② 下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
I.由表中数据判断ΔH2 0(填“>”、“<”或“=”),
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂
D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为
(从上表中选择);
 (2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的原电池装置。
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的原电池装置。
① 该电池工作时,OH-向_______极移动(填“正”或“负”),
② 该电池正极的电极反应式为 。
20.(11分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3  7N2+12H2O
7N2+12H2O
① 上述反应中被还原的元素是 (填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为 ,
 ② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
 Ⅰ、O3 O+O2 Ⅱ、NO+O3 NO2+O2
Ⅰ、O3 O+O2 Ⅱ、NO+O3 NO2+O2
 Ⅲ、 NO2+O NO+O2
Ⅲ、 NO2+O NO+O2
上述反应中NOx所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
|
方法Ⅰ |
用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
|
方法Ⅱ |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,是利用了SO2的
性质(选填字母编号)
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
②方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)=== S(g)+2CO2(g) ΔH1=8.0kJ·mol-1
2H2(g) +SO2(g)=== S(g)+2H2O(g) ΔH2=90.4 kJ·mol-1
2CO(g)+O2(g) === 2CO2(g) ΔH3=-566.0 kJ·mol-1
试写出S(g)与O2反应生成SO2的热化学方程式
。
19. (10分)元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的 ,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素。据此回答下列问题:
(10分)元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的 ,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素。据此回答下列问题:
(1)W在元素周期表中的位置 ,实验室制取W单质的离子方程式是 ;
(2)A、B均由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1。其中B是某种家用消毒液的有效成分,则A、B的化学式分别为 、 ;
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1∶1,则C中含有的化学键类型是 ;
(4)用B在碱性条件下处理含CN-的工业废水,将得到一种能够参与大气生态环境循环的气体以及CO32-、W-等,请写出该反应的离子方程式
(不必配平)。
18.(10分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
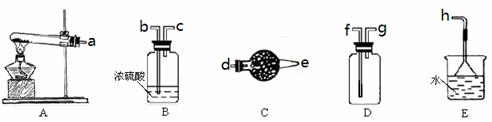
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选 填字母):a接 , 接 , 接h;
 (2)用右图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用
(选填字母编号);
(2)用右图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用
(选填字母编号);
A.碱石灰 B.生石灰 C.无水氯化钙
D.无水硫酸铜 E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的化学方程式
;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
。
17.(9分)钢铁工业是国家工业的基础,钢铁制品在生产生活中有着广泛的应用。
(1)钢材厂家在对钢材进行加工前往往要除去钢材表面的氧化物(如铁锈等),一种常见的方法是利用硫酸进行处理。
下列操作可以加快除去氧化物速率的是 (选填字母编号);
A.用98.3%的浓硫酸 B.用中等浓度的硫酸
C.适当地提高温度 D.加少许铜屑
(2)生产中也可用盐酸来除铁锈,现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生化合反应的化学方程式是 ;
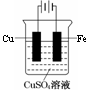 (3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如右图所示,请回答:
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如右图所示,请回答:
① 若电镀前铁、铜两电极的质量相等,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀过程中电路中通过的电子的物质的量是 ,
② 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
16.一定温度下,在2 L的密闭容器中发生反应:A(g)+2B(g) xC(g) △H<0,
xC(g) △H<0,
B、C的物质的量随时间变化的关系如下图。下列有关说法不正确的是
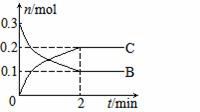
A.x=2
B.反应开始2 min内,v(B)=0.1 mol·L-1·min-1
C.2 min后,降低温度平衡向右移动
D.使用催化剂可以加快反应速率,但B的转化率不变
|
|||
|
|||
山东省日照市2011届高三上学期第一次调研考试
化学试题
第II卷(非选择题 共52分)
15.下列有关离子检验的操作和实验结论都正确的是
|
选项 |
实验操作及现象 |
实验结论 |
|
A |
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 |
该溶液中一定含有SO42- |
|
B |
向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 |
该溶液中一定含有CO32- |
|
D |
向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 |
该溶液中一定含有NH4+ |
14.某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B发生反应:
3A(g)+2B(g) 4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,
4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,
则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.若向平衡体系中加入少量C,则正、逆反应速率均增大
13.已知Cu+在酸性条件下能发生下列反应:Cu+ Cu+Cu2+(未配平)。
Cu+Cu2+(未配平)。
NH4CuSO3与足量的10 mol·L-1硫酸溶液混合微热,产生下列现象:
①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。
据此判断下列说法一定合理的是
A.该反应显示硫酸具有酸性
B.NH4CuSO3中铜元素全部被氧化
C.刺激性气味的气体是氨气
D.反应中硫酸作氧化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com