
题目列表(包括答案和解析)
19.(7分)(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为 ;
②膦(PH3)能和水发生微弱的化学反应,其水溶液呈弱碱性,该反应可用离子方程式表示为 。
(2)生活污水中含大量细小的悬浮物,可加重入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。
(3)用CH4催化还原NOX可以消除氮氧化物的污染。例如
CH4(g)+4NO2(g) 4NO(g)+CO2 (g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2= 。
18.(6分)食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是 。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 (填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。
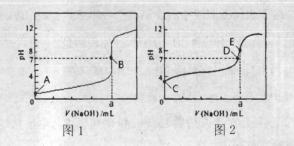
①滴定醋酸溶液的曲线是 (填“图l”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因用离子方程式表示 。
(4)现欲粗略澳9定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是 。
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
17.(7分)下表是部分短周期元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
|
原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
-3,+5 |
+2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2)X可与R按1:l的原子个数比形成化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的化合物乙,则乙的电子式为 。
(3)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为
mol·L-1。
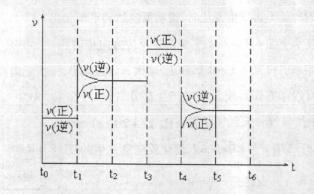
(4)化学反应3W2(g)+Y2(g) 2YW3(g);△H<0。当反应达到平衡时不断改变条件(不改变Y2、W2和YW3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中YW3的含量最高的一段时间是
。
2YW3(g);△H<0。当反应达到平衡时不断改变条件(不改变Y2、W2和YW3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中YW3的含量最高的一段时间是
。
16.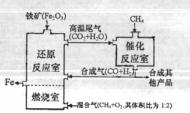 竖炉冶铁工艺流程如右图。使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧:CH4(g)+2O2(g)
竖炉冶铁工艺流程如右图。使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧:CH4(g)+2O2(g) CO2(g)+2H2O(g);△H1=-802kJ/mol,催化反应室发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g);△H2=+216kJ/mol;CH4(g)+CO2(g)
CO(g)+3H2(g);△H2=+216kJ/mol;CH4(g)+CO2(g) 2CO(g)+2H2(g);△H3=+260kJ/mol,(不考虑其他平衡的存在),下列说法正确的是 ( )
2CO(g)+2H2(g);△H3=+260kJ/mol,(不考虑其他平衡的存在),下列说法正确的是 ( )
A.设置燃烧室的目的是产生CO2和水蒸气作原料气与甲烷反应
B.催化室需维持在550-750℃,目的仅是提高CH4转化的速率
C.加入铁矿石时,将铁矿石粉碎,目的是加快反应速率提高原料利用率
D.增大催化反应室的压强,甲烷的转化率减小,平衡常数减小
15.一定温度下,l molXx和n mol Y在体积为2L的密闭容器中发生如下反应:
X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是 ( )
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是 ( )
A.用X表示此反应的反应速率是(0.1一0.2a)mol·(L·min)-1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入l mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动
14.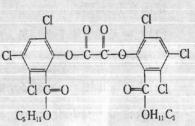 “魔棒”常被用于晚会现场气氛的渲染。“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如右图。下列说法正确的是 ( )
“魔棒”常被用于晚会现场气氛的渲染。“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如右图。下列说法正确的是 ( )
A.CPPO难溶于水
B.CPPO属于芳香烃也属于高分子化合物
C.1mol CPPO与NaOH稀溶液反应(不考虑苯环上氯原子水解),最多消耗4mol NaOH
D.1mol CPPO与氢气完全反应,需要10 mol H2
13.稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素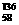 Ce、
Ce、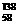 8Ce、
8Ce、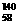 Ce、
Ce、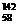 Ce,它们互为同位素
Ce,它们互为同位素
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
12.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析一定正确的是 ( )
A.KSP(PbS)<Kap(CuS)
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
11.下列涉及有机物的性质的说法错误的是 ( )
A.乙烯和聚氯乙烯都能发生加成反应
B.将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复成原来的红色
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
D.HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂
10.以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是 ( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.0l×1023个电子,得到的精铜质量为16g
④杂质Ag以.Ag2SO4的形式沉人电解槽形成“阳极泥”
A.②③ B.②④ C.③④ D.①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com