
题目列表(包括答案和解析)
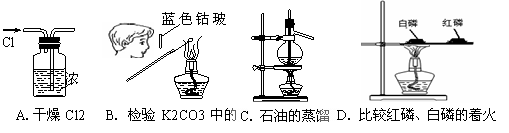
4.用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的的是
3.氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷。工业上可用下列方法制取:3SiO2+6C+2N2 高温 Si3N4+6CO。下列说法正确的是
A.氮化硅晶体属于分子晶体
B.氮化硅中氮元素的化合价为―3
C.上述反应中,N2是还原剂,SiO2是氧化剂
D.上述反应中,每生成1mol Si3N4,N2得到6mol电子
2.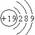
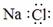 下列各项表达中正确的是
下列各项表达中正确的是
A.NaCl的电子式: B.钾原子结构示意图:
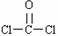
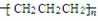 C.光气COCl2的结构式: D.聚丙烯的结构简式:
C.光气COCl2的结构式: D.聚丙烯的结构简式:
1.空气中的自由电子附着在气体分子或原子上形成的空气负离子(也叫阴离子)被人们称为“空气维生素”。下列各微粒中不属于空气负离子的是
A.O2― B.O2―·(H2O)n C.CO4―·(H2O)n D.PO43―
25.(6分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是: 和 。
(2)试通过计算确定该结晶水合物的化学式为 。
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol·L-1。
①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为
。
②若加人75mL的Ba(OH)2溶液,则得到的沉淀质量为 g。
24.(8分)乙基香草醛(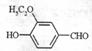 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)乙基香草醛分子中的含氧官能团有乙氧基、 (写名称)、 (写名称)。核磁共振谱表明该分子中有 种不同类型的氢原子。
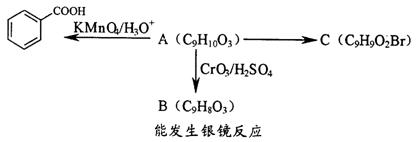
(2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
提示:a.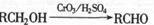 b.与苯环直接相连的碳原子上有氢时,该碳原子才可被KMnO4溶液氧化为羧基
b.与苯环直接相连的碳原子上有氢时,该碳原子才可被KMnO4溶液氧化为羧基
①写出A的结构简式 。
②写出在加热条件下C与NaOH水溶液发生反应的化学方程式 。
23.(6分)油脂是重要的营养物质。某天然油脂A可发生下列反应:
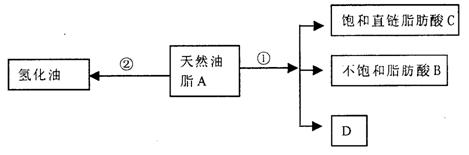
已知:A的分子式为C57H106O6。1mol该天然油脂A经反应①可得到1mol D、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C:H:O= 9:16:1。
(1)写出B的分子式: 。
(2)写出反应①的反应类型: ;C的名称(或俗称)是 。
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程。下列有关说法不正确的是 。
a.氢化油又称人造奶油,通常又叫硬比油。
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄人过多的氢化油,容易堵塞血管而导致心脑血管疾病。
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通人氢气,使液态油脂变为半固态或固态油脂。
d.油脂的氢化与油脂的皂化都属于加成反应。
(4)D和足量金属钠反应的化学方程式 。
22.(6分)有下列八种不饱和烃:
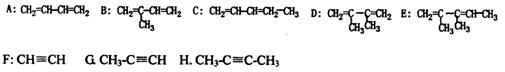
(1)已知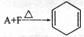 ,若要合成
,若要合成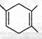 ,则下列所选原料正确的是__ 。
,则下列所选原料正确的是__ 。
①D和H ②E和H ③E和F ④B和H ⑤C和H ⑥D和G
(2)A和Br2的CCl4溶液发生反应时,可生成多种产物,写出这些产物的结构简式
, , , 。
21.(6分)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、
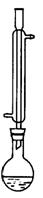 染料、助香料等有机化工产品的制备。氯化苄为无色液体,具有强烈的催泪
染料、助香料等有机化工产品的制备。氯化苄为无色液体,具有强烈的催泪
作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂。
工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。为探索不同光
强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测。
每一组检测按照如下步骤进行:
①称取0.255g样品。
②将样品与25 mL 4 mol·L-lNaOH水溶液在100 mL圆底烧瓶中混合,
水浴加热l小时后停止加热(在如图所示装置中进行反应,发生的反应为:
C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。
③在烧瓶中加入50 mL 200/0 HN03,混合均匀。
④将烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。
⑤从容量瓶中取出25.00 mL溶液于锥形瓶中,加入6.25 mL 0.100 mol·L-1AgNO3溶液,振荡混合均匀。
⑥在锥形瓶中滴人几滴NH4Fe(SO4)2溶液作为指示剂,用0.0250 mol·L-1 NHSCN溶液滴定剩余的AgNO3。
⑦重复⑤、⑥步骤三次,消耗0.0250 mol·L1NH4SCN溶液的平均值为6.75mL。
(已知:NH4CN+ AgNO3= AgSCN↓+NH4NO3)
根据以上实验信息回答下列相关问题:
(1)上图中烧瓶上的冷凝管所起的作用是 。
(2)步骤③所加硝酸的目的是 。
(3)在步骤⑤操作中,可用 (填仪器名称)取6.25 mL 0.1000 mol·L-l的AgNO3溶液。
(4)在步骤⑥操作中,判断达到滴定终点的现象是 。
20.(8分)有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质。为探究X的成分,设计方案并进行了如下实验:
I.将X粉末充分加热,有气体产生。
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液。
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰;透过蓝色钴玻璃观察,无紫色火焰。
Ⅳ,取Ⅱ中无色溶液,滴人KMnO4酸性溶液,紫红色不褪去。
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的
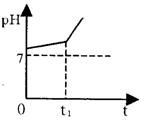 淀粉碘化钾试纸变蓝色。电解过程中测得溶液pH变化如
淀粉碘化钾试纸变蓝色。电解过程中测得溶液pH变化如
右图所示。
(1)根据实验Ⅳ可判断,一定不存在的物质是 。
(2)X的成分是 (填化学式)。
(3)实验V中,0~t时间内,两个电极上的电极反应式为:
阳极 ;阴极 。
(4)0→t1时间内,溶液pH升高比较缓慢的原因是:__ (用离子方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com