
题目列表(包括答案和解析)
3.2009年10月1日,在天安门广场举行了隆重的国庆阅兵仪式,展现了我国强大的综合国力,其中坦克的展示无疑是一个巨大的亮点。坦克的制造材料主要是各种金属的合金,铁便是其中十分重要的一种。下列关于铁的说法中正确的是
A.铁单质只具有还原性,其阳离子只具有氧化性
B.常温下,单质铁与浓硫酸不反应
C.铁元素属于过渡元素,其原子序数为26
D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
2.在陆地生态系统研究中,2H、13C、15N、18O、32S、33S等常用做环境分析的指示原子。下列说法中正确的是
A.32S与33S的中子数不等,属于两种不同的核素
B.13C和15N原子核内的质子数相差2
C.1H216O和2H218O分别与金属钠反应,所得气体的化学性质不同
D.2H+的酸性比1H+的酸性更强
1.化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是
A.纯净水几乎不含任何杂质,喝纯净水比喝矿泉水对人体更有营养
B.二氧化硫的大量排放是造成光化学烟雾的主要原因
C.某雨水样品放置一段时间后,pH由4.68变为4.28,是因为雨水中溶解了较多的CO2
D.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
21A.《物质结构与性质》模块(12分)
二茂铁[(C5H5)2 Fe]是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:
2C5H6+Fe(还原铁粉)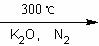 (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: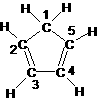 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),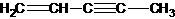 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
21B.《实验化学》模块(12分)
(12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是: 。
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入 (填化学式)试剂可达这一目的。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”)。
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN
(填“>”或“<”)。
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
20.某研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,锰化合物的还原产物都是MnCl2(如:K2MnO4+8HCl= MnCl2+2Cl2↑+2KCl+4H2O)。他们又进行了以下一些有关定量的实验,按要求填空或计算(气体体积都折合成标准状况):
(1)称取了31.6gKMnO4粉末,放在试管中加热充分反应后,收集到气体的体积是 ;另取31.6gKMnO4粉末和足量盐酸反应,收集到气体体积是 。
(2)将31.6gKMnO4粉末加热一段时间,收集到1.12L气体后停止加热,冷却后放入足量的浓盐酸再加热,又收集到气体体积是 。
(3)将a molKMnO4粉末加热一段时间,收集到V1L气体后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2L。则V2=
(用a、V1表达)。
19.(12分)某酯A的化学式为C9H10O2,且A分子中只含有1个苯环,苯环上只有一个取代基。现测出A的1H-NMR谱图有5个峰,其面积之比为1︰2︰2︰2︰3。利用红

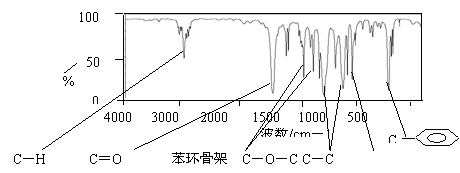 外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
试回答下列问题。
(1)A的结构简式可为C6H5COOCH2CH3 C6H5CH2OOCCCH3、 。
(2)A的芳香类同分异构体有多种,请按要求写出其中不含甲基且属于芳香酸的B的结构简式: 。
(3)已知C是A的同分异构体,分子中不含甲基,且遇FeCl3溶液显紫色,苯环上只有两个对位取代基的芳香醛,且有如下转化关系。

 ① 写出D E的化学方程式
。
① 写出D E的化学方程式
。
② 请用合成反应流程图表示出由C合成F的最合理的合成方案(注明反应条件)。
 提示:合成反应流程图表示方法示例如下:
提示:合成反应流程图表示方法示例如下:
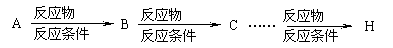
18.(10分)过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂(有活性氧存在),外观为白色自由流动颗粒,其制备流程如下图所示。图中BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成。
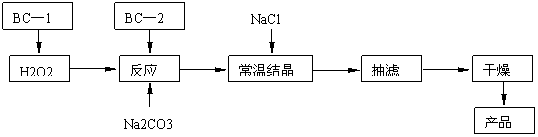
过碳酸钠简易制备工艺路线
(1)制备过程中加入BC-1的目的是 。
(2)结晶过程中加入氯化钠、搅拌,作用是 。
(3)洗涤抽滤产品,合适的洗涤试剂是 (填选项编号)。
A.饱和NaCl溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)写出制备过碳酸钠的方程式: 。
(5)由实验测定反应温度对产物的影响如下表:
|
T/°C |
活性氧百分含量 |
产率 |
|
5-10 |
13.94 |
85.49 |
|
10-15 |
14.02 |
85.78 |
|
15-20 |
15.05 |
88.38 |
|
20-25 |
14.46 |
83.01 |
根据上表数据,你认为反应最佳的温度选择的范围是 。
17.(10分)如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。

请回答下列问题:
(1)写出F的化学式: ;(2)写出G的电子式: ;
(3)反应①的化学方程式为 ;
人们将反应①所涉及的化学工业称为 ;
(4)反应⑤的离子方程式为 ;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒
② 。
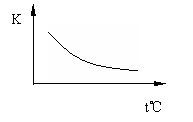
16.(8分)工业上制备H2的一种重要方法是:CO(g)+H2O(g) CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
 时间/min 时间/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c4 |
|
4 |
c1 |
c2 |
c3 |
c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q 0(填“>”、“=”或“<”)。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(4)上表中c2为 mol·L=1,CO(g)的转化率为 。
15.(12分)某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设:: 。
步骤二:查阅资料。得出:① +1价的铜在酸性条件下易发生自身氧化还原反应;
② 在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,
再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色
沉淀析出。
你认为合理的方案是(填字母) 。
(2)乙小组针对甲小组的假设,另设计如如下图装置进行验证。
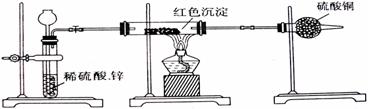
若按乙组装置定性检验上述红色沉淀成分,可根据 现象的发生与否即可判断。
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量 (填序号)。
①通入氢气的体积;②反应前红色沉淀和硬质玻管的总质量;③完全反应后红色固体和硬质玻璃管的总质量;④实验前干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有
(请写出两点)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com