
题目列表(包括答案和解析)
1.2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料。下列说法不正确的是
A.钯催化剂能提高碳原子反应的活性
B.钯催化剂能催化所有类型的有机反应
C.“钯催化交叉偶联反应”有利于人类合成复杂分子
D.利用该技术能改变合成路径,降低反应发生的条件
22.(10分)二次合金中含有金、银、铂、钯等贵重金属,实验室以二次合金为原料提取金、银、铂、钯等贵重金属的步骤如下,试回答下列问题:
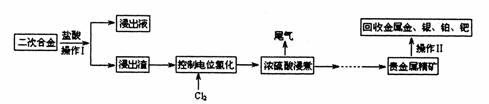
(1)浓硫酸浸煮过程中产生尾气的主要成分是 (填写代号,下同),欲对该气体进行检验,最好的试剂是 ;
A.H2 B.SO2 C.灼热的氧化铜粉末 D.品红试剂
(2)操作Ⅰ的实验名称是 ,完成该实验需要的玻璃仪器有 (填写仪器名称);
(3)实验室制备的Cl2中混有水蒸气和HCl杂质,甲同学设计了如下图所示的实验装置来证明水蒸气和HCl杂质的存在,请根据甲同学的设计意图完成下列有关问题。
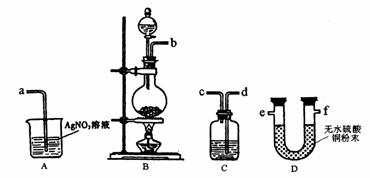
①各实验装置的接口顺序为:b接 , 接 , 接a;
②装置C的作用是 ;
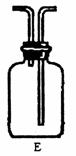 ③乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置E。你认为装置E应加在 之间
③乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置E。你认为装置E应加在 之间
(填装置序号),并且在广口瓶中放入
(填写所用试剂或用品名称)。
21.(10分)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH= ;
(2)丙溶液中存在电离平衡为
(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为 ;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:

①甲溶液滴定丙溶液的曲线是 (填“图1”或“图2”);
②a= mL。
20.(10分)据新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的汽化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s) +1/2O2(g)=CO(g) ΔH= -126.4 kJ·mol-1
2H2(g) +O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1 H2O(g)= H2O(l) ΔH= -44 kJ·mol-1
则在25℃,101kPa时:C(s) + H2O(g)= CO(g) + H2(g) ΔH=____________________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该平衡_______移动(填“向左”、“向右”或“不”),判断依据是
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
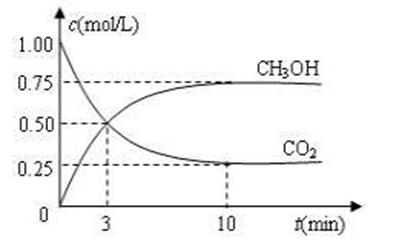
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
 |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|
||||||||||||
|
|||||||||||||
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②下列措施能使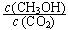 增大的是________(填符号)。
增大的是________(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
19.(10分)某化学过程的示意图如图所示,在装置工作过程中,甲池的总反应式为:2CH3OH+3O2+4NaOH=2Na2CO3+6H2O。试回答下列问题:
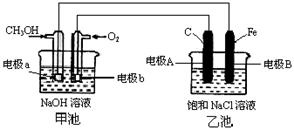
(1)甲池溶液中的Na+移向_______(填“a”或“b”)电极;乙池溶液中的Na+移向_______(填“A”或“B”)电极。
(2)电极A的名称为:______________;
(3)电极b上发生的电极反应为:________________________________。
(4)乙池中发生反应的离子方程式为___________________________________________。
(5)当乙池中电极A处得到0.71g产物时,甲池中理论上消耗O2_____________mL(标准状况下)
18.(12分)W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高。试回答下列各题:
(1)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,写出其中两种离子发生反应生成两种分子的离子方程式_______________________________________。
(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程_______________________________________________________
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式______________________________。
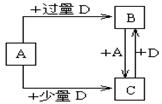 (4)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
(4)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离
子浓度由大到小的顺序为____________________________________________。
17.(8分)某研究性学习小组探究铁盐的性质和用途。
他们查阅资料知道,可以用铁盐溶液洗涤做过银镜反应实验的试管,原理是:
Fe3++Ag(s) Fe2++Ag+请回答下列问题:
Fe2++Ag+请回答下列问题:
(1)该小组研究了含有相同物质的量浓度的Fe3+的FeCl3和Fe2(SO4)3两种溶液哪种溶液洗涤效果更好。如果用相同体积的上述两种溶液,你认为 溶液洗涤效果更好,作出该判断的依据是 。
(2)甲同学提出,Fe(NO3)3溶液也可以做洗涤荆,但乙同学认为用Fe(NO3)3溶液做洗涤剂会产生一种红褐色沉淀和一种有毒气体。请写出该反应的离子方程式
(3)乙同学认为向做过银镜反应实验的试管中的溶液里加入几块铅笔芯也有利于除去银。你认为他的理由是 。
16.研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长。在工业上铜的冶炼大致可分为:①富集:将硫化物矿石进行浮选;②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;④电解精炼。
下列说法不正确的是
A.上述生产过程中的尾气可以通入氨水中,生产氮肥
B.每生产6mol Cu,理论上需消耗11mol O2
C.反应2Cu2O+Cu2S=6Cu+SO2↑中的还原剂是Cu2S
D.电解精炼时,粗铜应与外电源的正极相连
莱芜一中49级期末复习诊断性测试(二)
化学试题
第Ⅱ卷 非选择题(共 60分)
15.在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,
恰好使溶液的pH=7,下列叙述正确的是
A.溶液中2c(Na+)=c(SO42-) B.a/2 mol>沉淀的物质的量>0
C.沉淀的物质的量= a/2 mol D.原溶液中c(H2SO4) = a/2 mol/L
14.下表是元素周期表的一部分,有关说法不正确的是
 |
ⅠA |
ⅡA |
部分省略 |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
2 |
|
|
|
|
|
d |
|
|
|
3 |
a |
b |
c |
|
|
e |
f |
A.a、b、d、f四种元素的离子半径:f>d>a>b
B.元素b的单质不能与酸性氧化物发生化学反应
C.元素c的氧化物既能与酸反应又能与碱反应
D.a、c、e的最高价氧化物对应水化物之间能够相互反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com