
题目列表(包括答案和解析)
20.(9分)FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
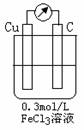
(1)右图是根据FeCl3腐蚀印刷电路铜板原理设计的原电池,
放电时正 极反应式为 。若将FeCl3
溶液浓度改为1.0mol/L,反应刚开始时,电流计读数将
_______(填“变大”、“变小”或“不变”)
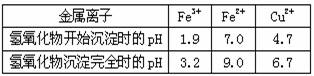
(2)腐蚀铜板后的混合溶液中,Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L。现有下列药品:Cl2、浓H2SO4、NaOH溶液、Cu(OH)2、Cu,请参照表中给出的数据,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
答:
。
19.(9分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(CH3COO-)>c(Na+)>c(H+)>c(OH-) ②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ④c(CH3COO-) >c(H+)>c(Na+)>c(OH-)
(1)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且两者恰好中和,则混合溶液中离子浓度的大小顺序为__________(填序号)。
(2)若上述关系①是正确的,则溶液中的溶质除含CH3COONa外,一定还含有的另一种溶质是 。
(3)若往某浓度醋酸溶液中逐滴加入氢氧化钠直至过量,该过程中混合溶液离子浓度变化趋势可能是 。
 A.① ② ③ ④
B.④ ① ③ ②
A.① ② ③ ④
B.④ ① ③ ②
 C.② ③ ① ④
C.② ③ ① ④
 (4)溶液中离子浓度是否还存在其他情况?如有,写出可能情况;如无,说明理由。
(4)溶液中离子浓度是否还存在其他情况?如有,写出可能情况;如无,说明理由。
答:___________________________________________
18.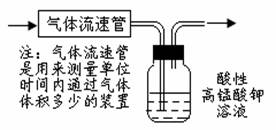 (12分)SO2、NOx是重要的空气污染源,必须经过处理后才能排放。一种工业尾气含SO2、O2、N2和CO2,某同学采用图示装置来测定该尾气中SO2的含量。
(12分)SO2、NOx是重要的空气污染源,必须经过处理后才能排放。一种工业尾气含SO2、O2、N2和CO2,某同学采用图示装置来测定该尾气中SO2的含量。
(1)实验过程中将观察到的现象是
。
(2)若该测定实验在标准状况下进行,且已知酸性高锰酸钾溶液的体积和浓度。现要通过上述装置测定尾气中SO2的体积分数,实验过程中,在已知尾气流速(恒定)的情况下,还需测定的数据是 。
(3)有专家提出:利用Fe2+、Fe3+的催化作用,常温下将SO2氧化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,尾气通入含Fe2+、Fe3+的溶液时,一个反应为4Fe2++O2+4H+=4Fe3++2H2O,另一反应的离子方程式为 。
(4)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
17.(12分)氢氧燃料电池是一种用氢气作为能源的电池。这种燃料电池的效率要比传统内燃机的效率高很多,所以燃料电池汽车(FCV)会有很高的效率。Schlesinger等人提出可用NaBH4与水反应制氢气: BH4-+2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原)。该反应的产氢速率受外界条件影响。下表为pH和温度对NaBH4 半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
|
体系 pH[ |
不同温度下NaBH4的半衰期(min) |
|||
|
0℃ |
25℃ |
50℃ |
75℃ |
|
|
8 |
4. 32 ×100 |
6. 19 ×10-1 |
8. 64 ×10-2 |
1.22
×10-2 |
|
10 |
4. 32 ×102 |
6. 19 ×101 |
8. 64 ×100 |
1.22
×100 |
|
12 |
4. 32 ×104 |
6. 19 ×103 |
8. 64 ×102 |
1.22
×102 |
|
14 |
4. 32 ×106 |
6. 19 ×105 |
8. 64 ×104 |
1.22
×104 |
根据要求回答下列问题:
(1)已知,NaBH4与水反应后所得溶液显碱性,则溶液中各离子浓度大小关系为_____________________。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?
答: 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?
答: 。
(4)实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应)。其可能原因是 。
16.(13分)碘在工农业生产和日常生活中有重要用途。
(1)右图为海带制碘的流程图。
步骤③的实验操作名称是 ;
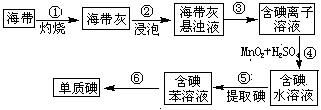 步骤④可用Cl2替代MnO2
步骤④可用Cl2替代MnO2
和H2SO4,替代后该步骤
发生反应的离子方程式为
。
若步骤⑤采用四氯化碳来提取碘,
将四氯化碳加入含碘水溶液并振荡,
将观察到的现象是 。
(2)碘单质遇淀粉变蓝。把滤纸用淀粉和碘化钾溶液浸泡,晾干后就是实验室常用的淀粉碘化钾试纸。利用淀粉碘化钾试纸可检验具有某种特性的气体。检验时,将淀粉淀粉试纸湿润,然后将湿润的试纸伸入集气瓶中,若试纸变蓝,证明存在具有某特性的气体。你认为淀粉碘化钾试纸用于检验具有_________的气体(填序号)
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
选择的理由是 。
15.实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是 ( )
 A.只用盐酸一种试剂就可以确定该固体M的具体成分
A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.用pH试纸检验,若pH=7,则固体M一定是Na2SO4
D.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
第Ⅱ卷(非选择题,共55分)
14.下列实验不能达到预期目的的是 ( )
|
序 号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的相对强弱 |
13.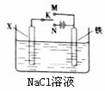 利用右图装置,可模拟铁的电化学防护。下列有关说法正确的是 ( )
利用右图装置,可模拟铁的电化学防护。下列有关说法正确的是 ( )
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
12.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是 ( )
|
X |
Y |
|
|
|
Z |
W |
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物酸性:Z>W>X
C.4种元素的氢化物中,Z氢化物最稳定
D.W单质与水反应,生成一种有漂白性物质
11.XY是中学化学中常见的化合物,已知组成该物质的两种离子的电子层结构与Ne相同。下列有关说法中不正确的是 ( )
A. 微粒通过离子键结合在一起 B. Y原子序数比X的更大
C. Y离子半径比X离子的大 D. 元素Y的氧化性比X强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com