
题目列表(包括答案和解析)
7.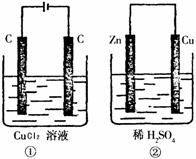 (改编自江苏省2011高三二轮检测)如图所示的两个实验装置中,溶液的体积均为
200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线中均通过0.02 mol电子,若不考虑气体的溶解和溶液体积的变化,则下列叙述中正确的是
(改编自江苏省2011高三二轮检测)如图所示的两个实验装置中,溶液的体积均为
200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线中均通过0.02 mol电子,若不考虑气体的溶解和溶液体积的变化,则下列叙述中正确的是
A.产生气体的体积:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:②中负极:Zn―2e―=Zn2+,①中阳极:Cu2++2e―=Cu
6.(改编自富阳中学2011高考模拟)经测定某溶液中只含有Na+、CH3COO-、H+、OH-四种离子,且离子浓度大小顺序为c(CH3COO-)>c(Na+) >c(H+) >c(OH-),其可能的情形是( )
A.该溶液是CH3COONa和CH3COOH的混合溶液
B.该溶液是CH3COONa溶液
C.该溶液是CH3COONa和NaOH的混合溶液ww.k@s@5@ 高#考#资#源#网
D.向该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为:
c(CH3COO-)>c(Na+) >c(OH-) >c(H+)
5.(原创)X、Y是周期表中前20号中的两种元素(非稀有气体元素),X原子的半径比Y的半径小,且具有相同的电子层数(m、n均为正整数),下列有关叙述正确的是
A.若Y最高价为+5,则X最高价一定为+6或+7
B.若HnXOm为强酸,则X的氢化物溶液于水一定显酸性
C.若Y元素形成的单质是气体,则X元素形成的单质一定也是气体
D.X的离子半径一定比Y离子半径小
4.(原创)下列说法正确的是
A.纸层析通常把不与水混溶的有机溶剂作固定相
B.牙膏中的甘油可用新制Cu(OH)2检验,可根据是否有绛蓝色沉淀生成来判断
C.NaNO2能与AgNO3溶液反应生成不溶于稀硝酸的白色沉淀
D.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
3.(改编自临川二中2011高考模拟)科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种。下列关于A的说法正确的是
A.A的分子式为C15H22O3
B.与FeCl3溶液发生反应后溶液显紫色
C.可以发生消去反应
D.1 mol A最多与1 mol H2完全加成
2.(原创)下列离子方程式不正确的是
A.苯酚溶液中加入Na2CO3:C6H5OH+CO32―→C6H5O―+HCO3―
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2++OH―+H++SO42―=BaSO4↓+H2O
C.向Ba(OH)2溶液中加入过量NaHSO3溶液: 2HSO3―+Ba2++2OH―=BaSO3↓+SO32―+2H2Oww.k@s@5@ 高#考#资#源#网
 D.甲醇-氧气燃料电池(KOH溶液作电解质溶液)负极的电极反应式:
CH3OH―6e―+8OH―=CO32―+6H2O
D.甲醇-氧气燃料电池(KOH溶液作电解质溶液)负极的电极反应式:
CH3OH―6e―+8OH―=CO32―+6H2O
1.(原创)下列有关海水综合利用的说法正确的是( )
A.从海水中可以得到NaCl,NaCl是制造化肥的原料
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质
D.利用潮汐发电是将化学能转化为电能
11、(15分)、PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线:
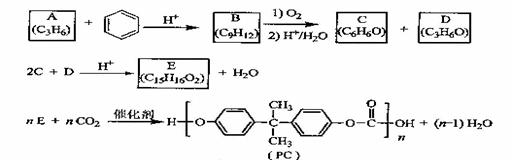
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;ww.k@s@5@ 高#考#资#源#网
③C可与FeCl3溶液发生显色反应:
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)A的化学名称是 ;
(2)B的结构简式为 ;
(3)C与D反应生成E的化学方程式为 ;
(4)D有多种同分异构体,其中能发生银镜反应的是 (写出结构简式);
(5)B的同分异构体中含有苯环的还有 种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是 (写出结构简式)。
8(16分)、
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ 对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ 对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ 对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ 对;无 |
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。ww.k@s@5@ 高#考#资#源#网
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去AI2O3的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为 。
9(13分)、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1) 在某温度下,反应物的起始浓度分别为:c(CO)= 1 mol,L-1, c(H2)=2 mol·L-1; 达到平衡后,H2的转化率为60%,平衡常数K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大ww.k@s@5@ 高#考#资#源#网
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
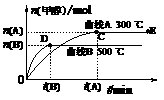
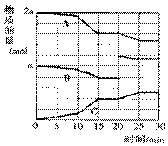 (4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是_____ 。
(4)反应过程中CO(g)、H2(g)、CH3OH(g)物质的量变化如图所示,分别用A、B、C表示CO、H2、CH3OH,根据图中所示判断下列说法正确的是_____ 。
A.10-15 min可能是加入了正催化剂
B.10-15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
D.20 min时可能是增加了B的量
10、(14分)、重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
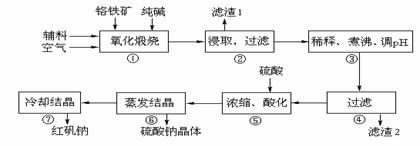
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
|
完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:ww.k@s@5@ 高#考#资#源#网
⑴“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是
⑵ “③”中调节pH至4.7,目的是 。
⑶ “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)称取重铬酸钠试样2.5000 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定
(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是:____________________________________;
②若实验中共用去Na2S2O3标准溶液40.00 L,所得产品的中重铬酸钠的纯度(设整个过程中其它杂质不参与反应)__________________________________________。
7.已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L。若在5mL含有KCI和KI各为0.01 mol/L的溶液中,逐滴加入5mL 0.01 mol/L AgNO3溶液形成浊液,下列叙述正确是( )
A.先生成AgCl沉淀 ,再生成AgI 沉淀
B.AgI的溶度积(KSP)为 1.23×10-10
C.浊液中Cl-和I-离子浓度之比约为1.03×106
D.如果不考虑水的蒸发,升高温度,则浊液中沉淀的质量不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com