
题目列表(包括答案和解析)
21、(13分)下表是实验室制备气体的有关内容:
|
编号 |
实验内容 |
实验原理 |
气体发生装置 |
|
① |
制备氧气 |
H2O2→O2 |
|
|
② |
制备氨气 |
NH4Cl→NH3 |
|
|
③ |
制备氯气 |
HCl→Cl2 |
|
.Com]
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是 (填气体名称,下同);从反应原理看,明显不同于其他两种气体的是 。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编 号填入上表中的空
号填入上表中的空
格中。
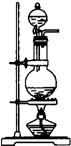
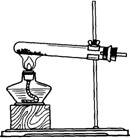
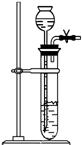
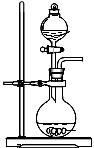
Ⅰ Ⅱ Ⅲ Ⅳ
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是 ,整套实验装置存在的明显缺陷是 。
②请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化:

(4)若用排空气法收集Cl2,在右边方框内画出气体收集装置图。
(5)若将多余的Cl2用100
mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知其pH等于13 (不考虑反应前后溶液的体积变化),ClO-和ClO3-的物质的量浓度之比为5∶1。则在整个过程中被氧化的氯气的物质的量为  mol。
mol。
20.将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9 mol,这些气体恰好能被500ml、2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( )
A.0.2mol B.0.4mol C.0.8mol D.0.9mol
第Ⅱ卷(非选择题 60分)
19.中学阶级介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。下列关于这三个工业生产的描述中正确的是( )
A.电解法制金属钠时,负极反应式:Na+ + e-= Na
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是 H2,NaOH 在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl ,在电解时它们的阴极都是 C1一 失电子
18.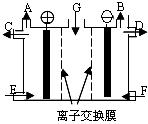 现有用离子交换膜(只允许对应的离子通过)和石墨作电极的电解槽电解饱和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是( )
现有用离子交换膜(只允许对应的离子通过)和石墨作电极的电解槽电解饱和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是( )
A.气体A是H2 ,溶液E是稀硫酸
B.气体B是H2 ,溶液D是NaOH溶液
C.Na2SO4 溶液由G口加入,F口加入稀硫酸
D.靠阳极室一侧的是阳离子交换膜,阴极室导出的是氢气
17.从下列事实所列出的相应结论正确的是( )
|
|
实 验 事 实[来 |
结 论 |
|
① |
Cl2的水溶液可以导电[来 |
Cl2是电解质 |
|
②. |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
③ |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
|
⑤ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.③④⑤ B.①②③ C.②③⑤ D.全部
16.有烯烃、炔烃混合 气a L,完全燃烧后生成b L CO2和c L水蒸气(温度、压强与原混合气相同),若a∶b∶c=3∶6∶4,则下列叙述中正确的是( )
气a L,完全燃烧后生成b L CO2和c L水蒸气(温度、压强与原混合气相同),若a∶b∶c=3∶6∶4,则下列叙述中正确的是( )
A.原混合气为体积比是1∶1的丙烯和丙炔 B.原混合气为任意体积比的乙烯和乙炔
C.原混合气为体积比为2∶1的丁烯和丁炔 D.原混合气为体积比为1∶2的乙烯和乙炔
15.常温下将浓度均为0.1 mol / L的CH3COOH和CH3COONa两溶液等体积混合,混合溶液的
pH<7,有关叙述正确的是( )
A.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1 B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.向混合后的溶液中滴入NaOH溶液至pH=7,则有c(Na+)=c(CH3COO-)
D.混合溶液加水稀释,c(OH- )减小
14.著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce 4+>Fe 3+>I2。)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI=CeI4 + 2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ = Ce3+ + 2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.四种的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体
13.下列四种判断:①两种弱酸相互反应生成两种强酸;②两种弱酸盐相互作用后生成两种强酸盐;
③一种弱酸和一种盐溶液作用后,得到一种强酸和一种盐;④两种酸溶液混合后,溶液的酸性
减弱。其中有具体例证的是( )
A.①②③④ B.①②③ C.②③④ D.①③④
12.有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应为:2H2 + O2 == 2H2O,负极反应为H2 + CO32--2e-= H2O + CO2。下列说法中正确的是:
A.正极反应为4OH--4e-= 2H2O + O2↑
B.放电时,电池中CO32-的物质的量将逐渐减少
C.放电时CO32-向负极移动
D.电路中的电子经正极、负极、熔融的K2CO3后再流回正极,形成闭合回路
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com