
题目列表(包括答案和解析)
4.用NA表示阿伏加德罗常数的值。下列叙述正确的是: ( )
A.电解精炼铜时,当阴极析出32g铜时,转移电子数小于NA
B.常温下,1.0L 1.0 mol/LNaAlO2溶液中含有的氧原子数为2NA
C.等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3
D.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA
3.下列各项中表达正确的是(
)
A.CO2的分子模型: B. F-结构示意图:
B. F-结构示意图: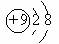
C.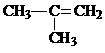 2-甲基-2-丙烯 D.HCl的电子式为:
2-甲基-2-丙烯 D.HCl的电子式为: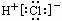
2.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是:( )
A.氯气 B.二氧化碳 C.醋酸钠 D.碘化钾
1.化学与生活、社会密切相关。下列说法正确的是:( )
A.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
B.动物油属于有机高分子化合物
C.工业上硝酸可用于制化肥、农药、炸药和染料等
D.用NaOH溶液雕刻工艺玻璃上的纹饰
26、(9分)氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。
为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1∶1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是 。
(2)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合气中 NO
和NO2的体积比是 。
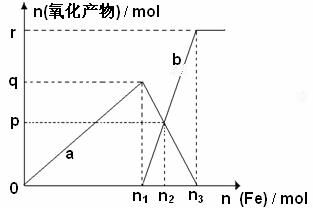
(3)含有1mol
HNO3的稀硝酸分别与 不同质量的铁粉,所得氧化产物a、b与铁粉物质的量
不同质量的铁粉,所得氧化产物a、b与铁粉物质的量
关系如图所示。则:b是 n 3 = p=
25、(12分)已知反应:
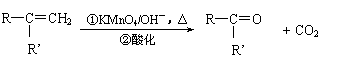

(R、R’可表示烃基或官能团)
A可进行如下反应(方框内物质均为有机物,部分无机产物已略去)。
|


(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作
用产生H2 22.4 L(标准状况),则F的分子式是 ,名称是 。
(2)G与F的相对分子质量之差为4,则G具有的性质是 (填序号)
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G最多可与2 mol 新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,又知两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是: 。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:
、 。
(5)A转化为B和F的化学方程式是:
。
24、(8分)在恒温恒容的密闭容器中,通入x mol
N2和y mol H2发生反应N2 + 3H2 2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴ 通过计算说明起始充入N2和H2的物质的量分别为:x = ,y = 。
⑵ 若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同。
① 若c=2,在相同的条件下达平衡时,该反应吸收的热量为 kJ。
② 若维持反应向正反应方向进行,则起始时c的取值范围为 。
0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶
液混合时体积的变化忽略不计)
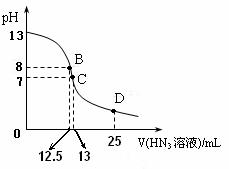
① D点时溶液中各离子的浓度由大到小的顺序为
② B点时溶液中c (HN3) =
23、(10分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2 → HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
 ⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为 ,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为
。
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为 ,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为
。
⑵ 联氨的电子式为 。
⑶ 右图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加
22、(8分) mA、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室
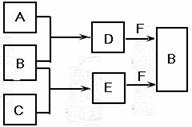 气体。其转化关系如图(反应条件和部分产物略去)。试回答:
气体。其转化关系如图(反应条件和部分产物略去)。试回答:
(1)单质X和B或D均能反应生成黑色固体Y,Y的化学式
是 。
(2)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B
的组成元素相同,Z分子中各原子最外层电子数之和为18。
Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(3)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶
液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(4)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进
行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。 (已知甲醇的燃烧热△H=-726.5 kJ/mol, 氢气的燃烧热△H=-285.8 kJ/mol )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com