
题目列表(包括答案和解析)
2.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.100mL 0.1mol/LNa2SO4溶液中,粒子总数是0.03NA
B.1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA
C.常温常压下,32g O2-中所含电子的数目为17NA
D.标准状况下,分子数为NA的N2,C2H4混合气体的质量无法确定
1.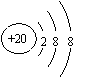 下列化学用语使用正确的是 ( )
下列化学用语使用正确的是 ( )
 A.质量数为37的氯原子:17
37Cl B.Ca2+的结构示意图为:
A.质量数为37的氯原子:17
37Cl B.Ca2+的结构示意图为:
 C.氢氧化钠的电子式:Na+ O
H- D.乙烯的结构简式:CH2CH2
C.氢氧化钠的电子式:Na+ O
H- D.乙烯的结构简式:CH2CH2
26、H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
(1)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是 ;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8 g上述混合物与一定量的浓硝酸充分反应,生成标准状况下1.568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
1. 00mL,末读数为 45.80mL,则合金中铁的含量为_____%
(保留2 位小数,已折算标况)。
25、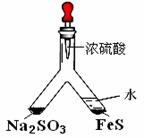 利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。
分析并回答下列问题:
(1)实验目的:验证SO2有氧化性。
将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,在支管
交叉处实验现象为__________________________________;
硫化亚铁处加水的目的是____________________________。
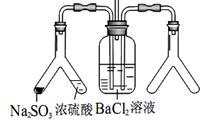 (2)实验目的:探究 SO2与BaCl2反应产生沉淀的条件。
(2)实验目的:探究 SO2与BaCl2反应产生沉淀的条件。
二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体
后可以产生白色沉淀。则右侧 Y型管中应放置的药品是
____________和___________(必要时可以加热),该沉淀的
化学式为________________。
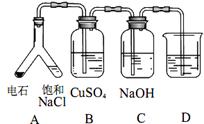 (3)实验目的:探究电石气中的成分。
(3)实验目的:探究电石气中的成分。
① 装置 A中发生的主要化学反应方程式为:
_________________________________________。
② B装置中出现黑色沉淀,C 装置的作用为__________。
③ 为验证电石气的主要成分,D中盛放______________。
(4)实验目的:锌铁合金中铁含量的测定
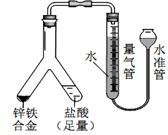 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液
①读取量气管中数据时,若发现水准管中的液面低于量气管中液
面,应采取的措施是___________________。
②若称得锌铁合金的质量为 0.117g,量气管中初读数为
24、(12分)某有机化合物A的结构简式如图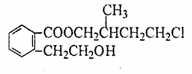 ,回答下列问题:
,回答下列问题:
(1)A的分子式为 。
(2)A在NaOH水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是 。
(3)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,
则D的摩尔质量为 。
(4)C酸化后可得F,F不能发生的反应类型是(填写字母代号) 。
a.取代反应 b.加成反应 c.消去反应 d.加聚反应
e.氧化反应 f.还原反应
(5)F可以发生如下转化,且G与H互为同分异构体。
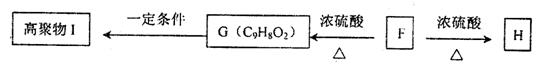
请写出:①H的结构简式 。
②由F生成G的化学方程式 。
(6)符合下列三个条件的F的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与F具有相同的官能团;③不与FeCl3溶液发生显色反应。
23、(10分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数均为14。
已知:甲为原子;乙、丙、丁为双原子分子或离子。
⑴ 甲单质与氢氧化钠溶液反应的离子方程式为 ;
⑵ 乙是双原子分子,在高温时是一种还原剂。14 g乙燃烧放出的热量是141.5 kJ。写出乙燃烧的热化学方程式 。
⑶ 丙为双原子二价阴离子,与钙离子组成的化合物能跟水反应产生一种可燃性气体。该可燃性气体能与乙酸在一定条件下,按物质的量比1∶1发生加成反应生成一种酯,该化学方程式是为 。
⑷ 由丁分子组成的物质属于单质,组成丁的元素最高价氧化物对应的水化物X有下图所示转化关系(反应条件和其他物质已略)
已知W为金属单质,W在周期表中的位置 。
写出X的稀溶液与Z反应的离子方程式:
。
22、(10分)A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
|
阳离子 |
Na+、Al3+、Ba2+、NH4+ |
|
阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
① A、D溶液呈碱性,B呈酸性,C呈中性
② A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③ A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝
回答下列问题:
(1)A的化学式是 ,用电子式表示C的形成过程: 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大
到小的顺序是:
(3)写出③的离子方程式
(4)简述D溶液呈碱性的理由
21、(10分)下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
|
元素 |
有关信息 |
|
A |
元素主要化合价为 -2,原子半径为0.074 n
m |
|
B |
所在主族序数与所在周期序数之差为4 |
|
C |
原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
|
D |
最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子 |
|
E |
原子半径为0.075 n m,最高价氧化物的水化物与其氢化物组成一种盐X |
(1)画出B的离子结构示意图 ;写出D元素最高价氧化物的水化物电子式 。
(2)盐X水溶液显 (填“酸”“碱”“中”)性,用离子方程式解释其原因 ;(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为 ;
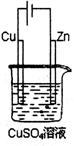 (4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20-30%的KOH溶液。该燃料电池放电时,正极的电极反应式是 。
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20-30%的KOH溶液。该燃料电池放电时,正极的电极反应式是 。
(5)如右图是一个电解过程示意图。假设使用Y-空气燃料电池作为本过程的
电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空
气(设空气中氧气的体积含量为20%) L。
20、向1LFeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br一)=3c(Cl一),反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br一)=0.4mol/L
第Ⅱ卷(非选择题 共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com