
题目列表(包括答案和解析)
4. 右图曲线a和b是盐酸与氧氧化钠的相互滴定的滴定曲线,下列叙述正确的是 ( )
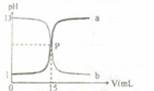 A.盐酸的物质的量浓度为1 mol·L-1
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的测定曲线
D.酚酞不能用做本实验的指示剂
[答案]B
[解析]根据起始时溶液的pH可知曲线a为NaOH溶液滴定盐酸的曲线,当V (NaOH)=0时,溶液的pH=1,由此可知c(HCl)=0.1 mol·L-1,选项A和C均错。强酸和强碱互滴,既可选用甲基橙又可选用酚酞作指示剂,D错。
[考点]电解质溶液--中和滴定
3.下列叙述正确的是 ( )
A.H2O2、SO2、氯水、过氧化钠、臭氧、活性炭都有漂白性,其原理相同
B.将SO2通入BaCl2溶液可生成BaSO4溶液
C.检验SO2中含有CO2的方法是通过澄清的石灰水
D.向含有BaCl2和NaOH的混合溶液中通入少量的CO2气体,有白色沉淀生成
[答案]D
[解析]H2O2、氯水、过氧化钠和臭氧因具有强氧化性而显漂白性,SO2因和有色物质发生化合而显漂白性,活性炭具有吸附性而显漂白性,A错。SO2和BaCl2溶液不反应,B错。SO2和CO2均能使澄清石灰水变浑浊,C错。
[考点]非金属元素及其化合物
2.下列有关比较中,大小顺序排列错误的是 ( )
A.沸点:NH3>PH3>AsH3 B.熔点:石英>食盐>干冰
C.结合质子的能力:CO43>CHCOO->SO32 - D.热稳定性:HF>HCl>HBr>HI
[答案]A
[解析]由于NH3分子间存在氢键,故NH3的沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的沸点高于PH3,因此选项A中正确的顺序为NH3>AsH3>PH3。
[考点]物质结构、元素周期律
1.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计),其中能表示等质量的氢气与氦气的是 ( )
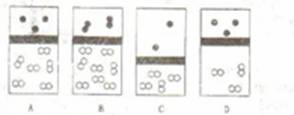
[答案]A
[解析]要注意氦气是单原子分子,当m(H2)=m(He)时,可得n(H2)=2n(He),根据相同条件下物质的量之比等于微粒数之比可知选项A正确。
[考点]物质的组成、性质和分类,化学用语及常用计量
2、 同分异构体的最简式相同。但最简式相同的化合物不一定是同分异构体,如C2H2与C6H6,HCHO与CH3COOH不是同分异构体。
1、 同分异构休的分子式相同,故相对分质量相同。但相对分子质量相同的化合物不一定是同分异构体,如C2H2与HCHO,C2H5OH与HCOOH不是同分异构体,
2. KClO3和MnO2混合共热:KClO3=2KCl+3O2↑(条件:在MnO2下加热)
工业制法:空气液化分离
四:氨气
实验室方法:
Ca(OH)2+2NH4Cl=====2NH3↑+CaCl2+2H2O
收集方法:向下排空气法、且容器口塞一团沾有稀H2SO4的棉花团,以防止所收集的气体与空气对流,也可吸收多余的NH3
净化方法:用碱石灰吸收NH3中混有的水分
工业制法:
N2+3H2=====2NH3 (条件:高温、高压、催化剂 且此反应为可逆反应
(上面的必需全部把握且对方程式一定要准确地记住,下面的只需知道)
五:氮气
实验室方法:NaNO2+NH4Cl==N2↑+2H2O +NaCl
工业方法:液态空气分馏法
六:二氧化氮
实验室方法:Cu+4HNO3(浓)====Cu(NO3)2+2H2O↑(条件加热)
工业方法:4NH3 + 5O2= 4NO + 6H2O(条件Pt/加热) 2NO + O2= 2NO2
七:一氧化碳
实验室方法:HCOOH===H2O+CO↑(条件加热)
工业方法:C + H2O(g) == CO + H2(条件高温)
八:二氧化硫
实验室方法:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
九:氢气
实验室制法:H2SO4+Zn=====ZnSO4+H2↑
2HCl+Zn=====ZnCl2+H2↑
收集方法:向下排空气法
工业制法:水煤气法 C + H2O(g) == CO + H2(条件高温)
有机中常见气体的制取方法
一:乙炔
实验室方法:
CaC2+2H2O→Ca(OH)2+CH≡CH↑
收集方法:排水集气法或向下排空气法
净化方法:因电石(CaC2)中含有CaS,与水反应会生成H2S,可用硫酸铜溶液或NaOH溶液将其除去。
二:乙烯
CH3CH2OH→CH2=CH2↑+H2O(条件:浓硫酸 170℃)
收集方法:排水法
净化方法:因酒精被碳化,碳与浓硫酸反应,乙烯中会混有CO2、SO2等杂质,可用盛有NaOH溶液的洗气瓶将其除去。
工业方法:石油裂解
1. KMnO4受热分解:2KMnO4=K2MnO4+MnO2+O2↑(条件:加热)
2.工业制法:CaCO3=====CaO+CO2↑(条件为高温)
三:氧气
实验室方法:
1.实验室方法:CaCO3+2HCl=CaCl2+CO2↑+H2O
收集方法:向上排空气法
净化方法:用饱和的NaHCO3除去HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com