
题目列表(包括答案和解析)
7.在中性含有Na+的溶液中,还可能存在NH4+,Fe2+,Br-,CO2-3,I一,SO2-3六种离子中的一种或几种,进行如下实验:
(1)原溶液滴加足量氯水后,有气泡生成,溶液呈橙黄色;
(2)向橙黄色溶液中加BaCI2溶液无沉淀生成
(3)橙黄色溶液不能使淀粉变蓝
由此推断原溶液中一定不存在的离子是: ( )
A.NH4+,Br-,CO2-3 B.NH+4,I-,SO2-3
C.Fe2+,I一,CO2-3 D.Fe2+,I-,SO2-3
6.下列叙述正确的是 ( )
A.Li在氧气中燃烧主要生成Li2O2
B.将SO2通入BaCl2溶液中可生成BaSO3沉淀
C.将CO2通人次氯酸钙溶液中可生成次氯酸
D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
5.25℃时,弱酸的电离平衡常数如右表,下列说法正确的是 ( )
 A.等物质的量浓度溶液pH关系:
A.等物质的量浓度溶液pH关系:
pH(NaCN)> pH(Na2CO3)>
pH(CH3COONa)
B.amol/L HCN与bmol/L NaOH溶液等体积
混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)==c(OH-)+c(HCO-3)+c(CO2-3)
4.NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.关于反应:C2H2(g)+ O2(g)==2CO2(g)+H2O(1);△H=-1300kJ/mol,若CO2中有4NA个共用电子对生成,则放出热量为1300kJ
O2(g)==2CO2(g)+H2O(1);△H=-1300kJ/mol,若CO2中有4NA个共用电子对生成,则放出热量为1300kJ
B.16g甲基正离子(13CH3+)所含中子数为9NA
C.200mL,0.lmol/L的Fe2(SO4)3溶液中阴离子和阳离子总数为0.1NA
D.0.1molFe与0.1molCl2充分反应转移电子数为0.2NA
3.下列叙述正确的是 ( )
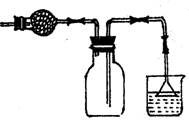 A.①分液,②过滤,③分馏,④重结晶都是混合物
A.①分液,②过滤,③分馏,④重结晶都是混合物
分离常用方法,其中根据粒子大小分离的只有②
B.欲配制质量分数10%的硫酸铜溶液,可准确称取
10g硫酸铜晶体溶于90g水中
C.中和滴定时,滴定前滴定管必须洗净并烘干
D.可用右图装置干燥、贮存并吸收多余的HCl气体
2.通过复习总结下列归纳正确的是 ( )
A.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
B.简单非金属阴离子只有还原性,丽金属阳离子不一定只有氧化性
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂与生成,也没有能量变化
1.化学在生产和日常生活中有着重要的应用。下列说法不正确的是 ( )
A.电解MgCl2饱和溶液,可制得金属镁
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.明矾水解形成的Al( OH)3胶体能吸附水中悬浮物,可用于水的净化
25.(15分)胆矾(五水硫酸铜)是一种常见的化合物,工业上它也是一种制取其它含铜化含物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:

pH控制可参考下列数据
|
物质 |
开始沉淀时的pH |
完全沉淀对的pH |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用 。(填字母)。
a.稀H2SO4 b.浓H2SO4/△ c.一浓FeC13溶液 d.浓HNO3
写出A物质溶解铜的化学方程式
(2)I中加H2O2的目的 。
(3)II中也可以加入下列物质中的 代替Cu2(OH)2CO3 (填字母)。
A.NH3 B.CuO C.NaOH D.Na2CO3 E.Cu(OH)2
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为 。
已知25℃时Fe(OH)3的溶度积为2.6×10-39,试计算25℃时,用溶液中Fe3+的浓度为
(5)IV过滤所需要的玻璃仪器除烧杯外还有 。
(6)V中加H2SO4调节pH=1是为了 。
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是 。

24.I(7分)将1 mof I2(g)1和2 molH2置于2L密闭容器中,在一定温度下发生反应:
I2(g)+ H2(g) 2H1(g);△H<0:,并达平衡。H1的体积分数w(HI)随时间变化如图晦线(II)所示:
2H1(g);△H<0:,并达平衡。H1的体积分数w(HI)随时间变化如图晦线(II)所示:
(1)达平衡时,I2(g)的物质的量浓度为____ 。
 (2)若改变反应条件,在甲条件下w(HI)的变传如曲线(I)所示,在乙条件下w(HI)的变化如曲线(Ⅲ)所示。则甲条件可能是
,则乙条件可能是
。(填入下列条件的序号)
(2)若改变反应条件,在甲条件下w(HI)的变传如曲线(I)所示,在乙条件下w(HI)的变化如曲线(Ⅲ)所示。则甲条件可能是
,则乙条件可能是
。(填入下列条件的序号)
A.恒容条件下,升高温度;
B.恒容条件下,降低温度;
C.恒温条件下,缩小反应容器体积;
D.恒温祭件下,扩大反应容器体积:
E.恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mo1 I2(g)、bmo1H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是 。
II.(8分)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B H++HB- HB一 H++B2一
H++B2一
回答下列问题:
(1)Na2B溶液显_ ___(填“酸性”,“中性”,或“碱性”)。
理由是 (用离子方程式表示)。
(3)已知0.1.mol/L NaHB溶液的pH =2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是 0.ll mo1·L-l(填“<”,“>”或“=”),理由是: 。
(3)0.1 mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是 。
23.(10分)
(1)肼(N2H4)义称联氨,是一种可燃性的液体,
可用作火箭燃料。已知在 101kPa时,32.0gN2H4
在氧气中完全燃烧生成氮气,放出热量624kJ
(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。
肼一空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积分数为20%)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com