
题目列表(包括答案和解析)
5.25℃时,弱酸的电离平衡常数如右表,下列说法正确的是 ( )
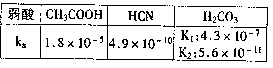 A.等物质的量浓度溶液pH关系:
A.等物质的量浓度溶液pH关系:
pH(NaCN)> pH(Na2CO3)>
pH(CH3COONa)
B.amol/L HCN与bmol/L NaOH溶液等体积
混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)==c(OH-)+c(HCO-3)+c(CO2-3)
4.NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.关于反应:C2H2(g)+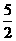 O2(g)==2CO2(g)+H2O(1);△H=-1300kJ/mol,若CO2中有4NA个共用电子对生成,则放出热量为1300kJ
O2(g)==2CO2(g)+H2O(1);△H=-1300kJ/mol,若CO2中有4NA个共用电子对生成,则放出热量为1300kJ
B.16g甲基正离子(13CH3+)所含中子数为9NA
C.200mL,0.lmol/L的Fe2(SO4)3溶液中阴离子和阳离子总数为0.1NA
D.0.1molFe与0.1molCl2充分反应转移电子数为0.2NA
3.下列叙述正确的是 ( )
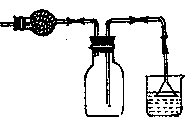 A.①分液,②过滤,③分馏,④重结晶都是混合物
A.①分液,②过滤,③分馏,④重结晶都是混合物
分离常用方法,其中根据粒子大小分离的只有②
B.欲配制质量分数10%的硫酸铜溶液,可准确称取
10g硫酸铜晶体溶于90g水中
C.中和滴定时,滴定前滴定管必须洗净并烘干
D.可用右图装置干燥、贮存并吸收多余的HCl气体
2.通过复习总结下列归纳正确的是 ( )
A.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
B.简单非金属阴离子只有还原性,丽金属阳离子不一定只有氧化性
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂与生成,也没有能量变化
1.化学在生产和日常生活中有着重要的应用。下列说法不正确的是 ( )
A.电解MgCl2饱和溶液,可制得金属镁
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.明矾水解形成的Al( OH)3胶体能吸附水中悬浮物,可用于水的净化
22.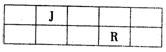 (7分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(7分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)元素T在周期表中位于第____族。
(2)M和T形成的化台物在潮湿的空气中形成酸雾,
反应的化学方程式为 。
(3)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 。
21.(8分)X、Y、Z、W均为短周期元素组成的物质,它们之间有如图所示转化关系:

请从你所学的知述要求的X、Y、Z、W的组合。
|
|
X |
Y |
Z |
W |
备注 |
|
(1) |
|
|
|
|
W为单质 |
|
(2) |
|
|
|
|
W为酸 |
|
(3) |
|
|
|
|
W为碱 |
|
(4) |
|
|
|
|
W为氧化物 |
20.(9分)为减少和消除CO2对环境的影响,有科学家提出“绿色自由”的构想。既先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
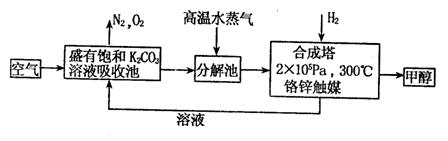
(1)写出分解池中反应方程式:
(2)在合成塔中,当有4.4kgCO2与足量H2完全反应,可放出热量4947kJ,写出合成塔中反应的热化学方程式:____
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式:
19.(12分)海水中不仅含有丰富的非金属元素资源,(如CI,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: ;写出氯化钠的电子式: ;
与Na,Cl同周期,且简单离子半径最小的离子结构示意图:
(2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:①溶解,② ,③加过量Na2CO3溶液,④ 。
⑤过滤除去杂质,⑥ ,⑦蒸发结晶;
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体。
有关资料:
|
M(OH)n |
pH |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe(OH)2 |
7.6 |
9.6 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Mg(OH)2 |
9.5 |
11.0 |
|
Cr(OH)3 |
4.3 |
5.0 |
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,则最佳试剂选择和操作是:
①先加 ;目的是 ;
②再加 ;目的是 ____,
③过滤后,为能得到纯净MgCl2晶体,采用的操作方法是: 。
18.(7分)随着环保意识的增强,清洁能源越来越受人们关注,
(1)甲烷是一种洁净能源,已知:
CH4(g)+ 2O2(g)===CO2(g)+ 2H2O(g);△H=-830kJ/mol
H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为: ;
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:
CH4(g)+H20(g) CO(g)+3H2(g)△H=+206.1kJ/mol
CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)= 2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是: (填序号)
A.V正>V逆 B.V正<V逆
C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1 K2;(填“>”,“<”或“=”)
(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:
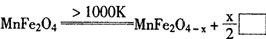
则框内的物质为: ;
第二步反应方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com