
题目列表(包括答案和解析)
7.设NA为阿伏加德罗常数的数值,则下列说法正确的是 ( )
A.在标准状况下,22.4L HF中含有的分子数为NA
B.在标准状况下,11.2L NO 与11.2 L O2混合后气体分子数为0.75NA
C.常温常压下,足量的Fe在1mol Cl2中充分燃烧,转移的电子数为2NA
D.106g Na2CO3固体中的阴离子数大于NA
28.(14分)1 mol的某有机物甲在O2中充分燃烧,可得到等体积的CO2和H2O(g ) ,并消耗112 L O2(标准状况);又知甲的相对分子质量小于100,1 mol甲在酸性条件下可水解生成1 mol 乙和1 mol丙,且丙通过一定途径可转化为乙。
(1)甲的分子式为
。
己知:① ROH + HBr(氢溴酸) RBr + H2O
RBr + H2O
②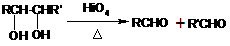
A与甲为同分异构体,且A中含有碳氧双键,B只生成C,与A相关的反应如下:

(2)写出反应类型:E→ F , F→ G ______________
(3)写出A 、G 的结构简式:A 、G 。
(4)写出下列转化的反应化学方程式: www.k@s@5@ 高#考#资#源#网
B→D ;
C在反应条件只为①下发生反应的化学方程式
为 。
(5)A 在空气中久置,可转化为相对分子质量为86 的化合物H , H 的一氯代物只有一种,写出H 的结构简式:__________________________________________。
www.k@s@5@ 高#考#资#源#网
27.(16分)某研究性小组借助A-D的仪器装置完成有关实验


[实验一]收集NO气体。
(1) 用装置A收集NO气体,正确的操作是 (填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d.从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上的锌的质量分数 和镀层厚度,查询得知锌易溶于碱Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究此目标。
(2)选用B和_________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),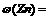 _________。
_________。
(4)计算镀层厚度,还需要检索的一个物理量是_______________。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_______(填“偏大”、“偏小”或“无影响”)。 www.k@s@5@ 高#考#资#源#网
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(6)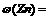 _______________。
_______________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙_______________方案乙(填“优于”、“劣于”或“等同于”)。
26. (16分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应
A(g) + 2B(g) 3C(g),已知加入1molA和3molB且达平衡后生成a
molC,
(16分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应
A(g) + 2B(g) 3C(g),已知加入1molA和3molB且达平衡后生成a
molC,
回答下列问题:
(1)平衡时C在反应混合气体中的体积分数是____________(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6molB,达平衡后,C的物质
的量为______mol(用字母a表示)。此时C在反应混合气中的体积分数 (填增大、减少或不变)。 www.k@s@5@ 高#考#资#源#网
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在
反应混合气中的体积分数不变,则还应加入C_________mol。
(4)在同一容器中加入n molA和3n molB,在平衡时C的物质的量为mmol,若改变实验
条件,可以使C的物质的量在m-2m之间变化,那么n与m的关系应是
_____________________(用字母m、n表示)。
27.(14分)纯净物X、Y、Z、P、Q转化关系如下图所示(图中某些生成物已略去),物质X与物质Y之间的反应不在溶液中进行,通常状况下P为气体。

请回答下列问题:
 (1)若X、Y、P均为短周期元素的单质,且气体P就是物质Y,又知P不可燃,则X的
(1)若X、Y、P均为短周期元素的单质,且气体P就是物质Y,又知P不可燃,则X的
原子结构示意图是__________, 化合物Q的电子式为________________________。
实验室加热制取气体P的化学方程式为:______________________________________。
(2)若Y为单质,X、P为化合物,且气体P就是物质X,X与Y常温下发生反应,化
合物Z显红棕色,则Z的化学式为__________,写出化合物Q分解的化学方程式:
____________________________________________________________。
(3)若气体P为有机化合物,且CO2能使化合物Q的澄清溶液变浑浊,写出化合物Z与
水反应的化学方程式:_______________________________________________________。
13.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应水化物的化学式为H2YO4
B.原子序数由小到大的顺序为W<X<Y<Z
C.Y、Z两元素的简单离子的半径Y>Z
D.X与W可以形成W2X、W2X2两种化合物
12.从矿物学资料查得,一定条件下自然界存在如下反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。
下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物 www.k@s@5@ 高#考#资#源#网
D.FeS2只作还原剂
11.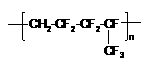 维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式见下图,合成它的单体为(
)
维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式见下图,合成它的单体为(
)
A.氟乙烯和全氟异丙烯 B.1,1-二氟乙烯和全氟丙烯
C.1-三氟甲基-1,3-丁二烯 D.全氟异戊二烯
10.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时负极反应为:
B.充电时阳极反应为: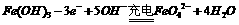
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
8.已知甲酸钠(HCOONa)溶液呈碱性。室温下用c(H+)相同、体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是( )
A.加水稀释,两溶液中的氢离子数目都不变
B.用等浓度NaOH溶液中,盐酸比甲酸消耗的碱液少
C.跟等质量铝粉反应,盐酸比甲酸的起始反应速率快 www.k@s@5@ 高#考#资#源#网
D.跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
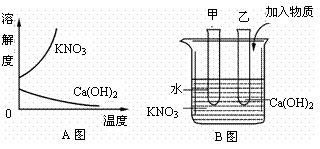 9.图中A表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体增加,乙试管中的固体减少,则加入的物质可能是(
)
9.图中A表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体增加,乙试管中的固体减少,则加入的物质可能是(
)
A.硝酸铵 B.氢氧化钠 C.浓硫酸 D.氯化钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com