
题目列表(包括答案和解析)
28.(14分)化合物A、B均是分子式为C8H8O8的无色液体,均难溶于水。从A、B开始,可发生图示的一系列反应(反应中的无机物已部分略去),E的苯环上的一元硝基化物只有两种,K可发生银镜反应。
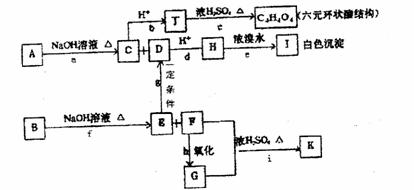
(1)写出A和K的结构简式:A K ;X与K互为同分异构体且也可发生银镜反应,则X所含官能团的电子式为 。
(2)上图a-i的反应中,属于酯化反应的有 (填字母)
(3)写出反应a的化学方程式是 。 www.k@s@5@ 高#考#资#源#网
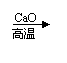
(4)已知CH3COONa+NaOH CH4↑+NA2CO3,请完成ED的反应方程式 。
(5)实验室配制银氨溶液的主要操作是 ;写出K与足量银氨溶液反应
的离子方程式 。
(6)芒香族化合物W与A互为同分异构体且满足以下条件:①1molW能与含3molNaOH
的溶液恰好反应,②苯环上不直接连甲基,则符合上述条件的W的同分异构体有
种。


27.(16分)
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
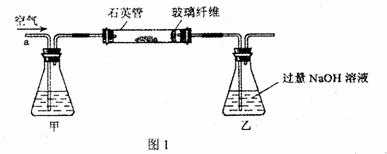
I.将m,g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
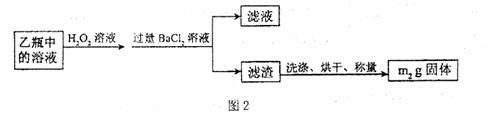
II.反应结束后,将乙瓶中的溶液进行如图2处理。
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是 。
(2)I中,甲瓶内所盛试剂是 溶液;乙瓶内发生反应的离子方程式有 ;I中玻璃纤维的作用是 。
(3)II中的滤渣在称量前还应进行的操作是 ;II中,所加H2O2溶液需足量的理由是 。 www.k@s@5@ 高#考#资#源#网
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有 ;④中取稀释液25.00mL需用的仪器是 。
(5)该黄铁矿中硫元素的质量分数 (用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数 (用I、II中有关实验数据表达)
26.(14分)A、B、X、Y、Z、W、Q、R是原子序数依次增大的八种短周期主族元素,A和B、Z和W左右相邻,A和Z、B和W上下相邻;Y在同周期中原子半径最大,R在同周期中原子半径最小;X与Q同主族,能形成QX3化合物。已知Z是金属,其氧化物和氢氧化物均显两性。
(1)写出Z的氧化物与少量Y的最高价氧化物对应水化物的溶液反应的离子方程式 。
(2)单质B、W和WB都是熔点高、硬高大的晶体,B、W、WB、Y的一种氧化物、Q的单质和R的单质,它们的熔点由高到低的顺序(填化学式) 。
(3)A和R能生成共价化合物AR3,该分子是否满足8电子稳定结构 (填“是”或“否”),该分子是 (填“极性”或“非极性”)分子,它和潮湿空气里的水分作用会产生大量白雾,写出其反应的化学方程式 。
(4)由等物质的量浓度Y2QX4和Z2(QX4)3组成的混合液,若在该混合液中逐滴加入氢氧化钡溶液,产生沉淀量最大时的离子方程式是 。
(5)已知锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则该电池正极反应为 。以B、Z为电极可以组成海水电池,这种电池的能量比锌锰干电池高20-50倍,可用作航标灯的电源,写出该原电池负极的电极反 。 www.k@s@5@ 高#考#资#源#网
25.(14分)已知:E为常见金属,C、D、E、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,B的结构为三角双锥(如图所示),图中○代表F分子,●代表E原子,它们有如下框图关系:
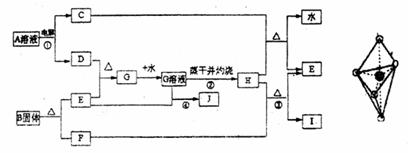
(1)H的颜色是 ;B的化学式是 ;I的电子式是 。
(2)反应①阳极的电极反应式 。
(3)反应③的化学方程式是 ,该反应在工业上的用途是 。
(4)反应④的离子方程式 。
(5)从G溶液制得G的结晶水合物的操作是 。
(6)反应②蒸干并灼烧最终得H而不是无水的G,试用简要文字和方程式解释: 。
13.取一定质量含Cu、Cu2、和CuO的固体混合物,将其分成两等份并进行下列转化:
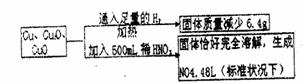
则转化过程中所加稀HNO3的物质的量浓度为 ( )
A.3.2mol/L B.3.6mol/L C.4.0mol/L D.4.4mol/L
www.k@s@5@ 高#考#资#源#网
第Ⅱ卷
12.将2mol
A和2molB充入某密闭容器中发生如下反应:2A(g)2+B(g) xC(g),达到化学平衡后,C的体积分数为a,假设该反应的条件分别和下列各选项的条件相同,下列判断有不正确的是 ( )
xC(g),达到化学平衡后,C的体积分数为a,假设该反应的条件分别和下列各选项的条件相同,下列判断有不正确的是 ( )
A.恒温恒容下:当x=1时,将1molB、1molC作为起始物达平衡后,C的体积分数是a
B.恒温恒容下:当x=2时,将2molC作为起始物达平衡后,C的体积分数一定小于a
C.恒温恒容下:当x=3时,将2molB、6molC作为起始物达平衡后,C的体积分数是a
D.恒温恒压下,将3molA、3molB作为起始物达平衡后,C的体积分数是a,则x可为任意正整数 www.k@s@5@ 高#考#资#源#网
11.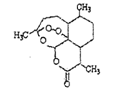 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关化合物的叙述正确的是 ( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关化合物的叙述正确的是 ( )
A.分子式为: C16H22O2
B.该化合物在一定条件下不能与NaOH溶液反应
C.该化合物中含有过氧键,一定条件下有氧化性
D.菁蒿素与维生素一样是水溶性的
10.利用反应:2Ag(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计原电池并用它作电源进行电解的装置如图所示。NaCl溶液的体积为200mL,假设反应产生的气体全部放出,且反应前后溶液体积的变化忽略不计。下列有关叙述错误的是 ( )
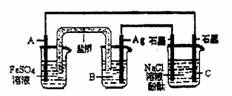 A.电极A应该用Fe作材料,B是AgNO3溶液,电极C周围溶液变红
A.电极A应该用Fe作材料,B是AgNO3溶液,电极C周围溶液变红
B.A、C两极都发生氧化反应,C电极反应式为:2H++2e-=H2↑
C.银电极变粗,为电源的正极,A电极反应式为:Fe-2e-=Fe2+
D.当析出Ag 21.6g时,NaCl溶液的pH是反应前的2倍
9.下列溶液中有关微粒的物质的量浓度关系正确的是 ( )
A.常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合后液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO)>c(OH)>c(H+) www.k@s@5@ 高#考#资#源#网
B.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):C(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③ www.k@s@5@ 高#考#资#源#网
D.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液②pH=3的HCl溶液③pH=11的氨水中由水电离出的c(H):①>③>②
8.下列反应的离子方程式程式中正确的是 ( )
A.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应:CH3OH+H2O-6e-=CO2↑+6H+
B.在NaHSO4溶液中加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)2↓+CO32-
D.往饱和氯化钠溶液中通入足量氨气和二氧化碳后有NaHCO3晶体析出:
Na++NH3+CO2+H2O=NaHCO3↓+NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com