
题目列表(包括答案和解析)
5、(原创题)下列离子方程式正确的是
A.等物质的量浓度的FeI2溶液与溴水等体积混合2Fe2++2I-+2Br2=2Fe3++I2+4Br-
B.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ ==Fe3+ + 3H2O
C.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
命题意图:离子方程式历来是化学教学中的重点,也是高考较为容易考察到的知识点。离子方程式的涉及面很广,尤其是和氧化还原反应或因为反应物量不同导致的多可能反应结合起来,学生显得最为困难。本题的出现旨在引起学生对于离子方程式的重视。
4、(原创题)设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,18克H2O所含电子数为10 NA
B.将1mol FeCl3全部化成胶体,其中氢氧化铁胶粒数为NA
C.在常温常压下,11.2L氧气所含的原子数目为NA
D.标准状况下2.24L的SO3所含的原子数为0.4NAww.k@s@5@ 高#考#资#源#网
命题意图:阿伏加德罗常数所涉及的知识点有相当丰富,导致阿伏加德罗常数相关试题在高考中的出现频率极高,近几年理科综合浙江卷中,只有08,10年未出现这一知识点,其余众多年份都有考到,足以说明阿伏加德罗常的重要性。
3、(2010届华维中学高三专题复习第1题)下列结论均出自《实验化学》中的实验,其中错误的是
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘。
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据。
C.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干。
D.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量。
命题意图:本题各个选项都来源于《实验化学》一书,新教材把实验化学单独列为一册,与老教材相比,不仅涉及实验的基本操作,定性、定量实验,制备合成实验等,还结合了许多全新实验案例,而这些案例中有许多固定的细节问题。我们在教学中往往容易凭借老教材的教学经验,忽略了这些案例中的细节,本题的出现旨在唤起师生对《实验化学》一书的重视。
2.(原创题)我们学习化学很重要的一个方面就是解决生活中的实际问题,下列家庭小实验不合理的是
A.用灼烧并闻气味的方法检验真皮衣料
B.用淀粉和水检验食盐中的碘元素ww.k@s@5@ 高#考#资#源#网
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用食醋除去热水壶中的水垢
命题意图:近几年高考命题都有一个共性,就是与生活实际联系非常紧密。我们的学生却刚好相反,对于一些生活中常见的问题,当需要用化学知识去加以解释时,常常显得束手无策,本题旨在引起学生重视生活相关的化学问题。
1、(原创题)下列说法中不正确的是 ( )
① 铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
② 汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
③ 用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖;
④ 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
⑤ 明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝;
⑥“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
A. ②③⑤ B. ①②④ C.③④⑥ D. ③④⑤
命题意图:高中化学所涉及的知识点有很多,分布在不同的模块中,但理科综合化学部分只有“7+4”,题量之少,但又要尽可能多的覆盖到各类知识模块,本题的出现就能很好解决这一矛盾。
11、(2009无锡调研28改编)(14分)苯佐卡因是一种局部麻醉剂,可用于粘膜溃疡、创面等的镇痛,一般制成软膏或栓剂使用,它的工业合成有如下所示的两种途径。途径I已逐渐淘汰,现在使用较多的是途径II。ww.k@s@5@
高#考#资#源#网
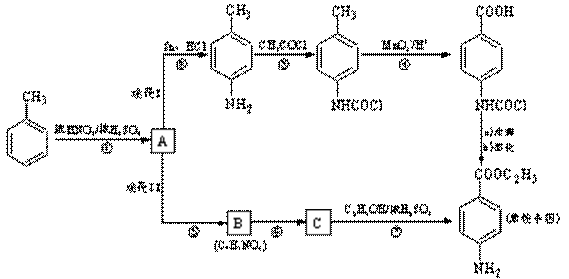 已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
 请回答下列问题:
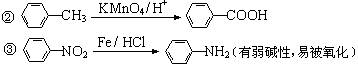
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成
请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成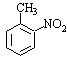 、
、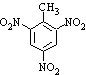 等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2Oww.k@s@5@
高#考#资#源#网
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。
等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2Oww.k@s@5@
高#考#资#源#网
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。
9.(原创)(14分)25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
 (2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
醋酸的电离程度将如何变化
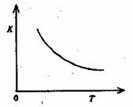
电离平衡常数将如何变化 (4)合成氨发生的反应为N2+3H2 2NH3。400"C时,该反应平衡常数K=0.5mol-2。·L2。已知该反应的平衡常数与温度的关系如图所示。500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正 v(N2)逆
(填>、<、=或不能确定)。请书写判断理由
ww.k@s@5@ 高#考#资#源#网
10.(2010徐州一研18)(16分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
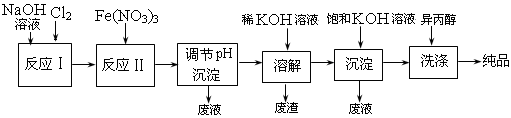
(2) ①反应I的化学方程式为
。
②反应II的离子方程式为
。
③加入饱和KOH溶液的目的是
。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为
,__________。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
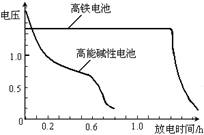
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 、 。
8. (2010四川高考26)(14分)短周期元形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,又能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。 请回答下列问题: (1)组成单质A的元素位于周期表中第 周期,第 族。 (2)B与氢氧化钠溶液反应的化学方程式为: (3)C与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化物为 ,当生成2mol二氧化氯时,转移电子 mol (4)溶液F在空气中长期放置生成H的化学方程式为: (5)H的溶液与稀硫酸反应产生的现象为
6.(原创) 下列有关说法正确的是
A.标准状况下,2.24LSO3含原子总数为0.4NA
B.Na2 O2与H218O反应: 2 Na2 O2 + 2H218O =4Na++ 4OH- + 18O 2↑ww.k@s@5@ 高#考#资#源#网
C. .KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+ H2O2 + 2 H+ =2H2O+ I2
D.接触法制硫酸工艺中,在450℃并有催化剂存在下将2mol SO2和1 mol O2置于密闭容器充分反应放热190 kJ,其热化学方程式为:2SO2(g)+O2(g)
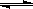 2SO3(g)
△H=-190kJ/ mol
7. (07海淀期中)在某无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-离子中的几种。某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加入AgNO3溶液,有白色沉淀产生;(3)另一份加入BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是
A.Na+、Fe3+、SO42- B. Na+、SO42-、CO32-
C.Ca2+、Br-、SO42- D. CO32-、Cl-、SO42-
2SO3(g)
△H=-190kJ/ mol
7. (07海淀期中)在某无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-离子中的几种。某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加入AgNO3溶液,有白色沉淀产生;(3)另一份加入BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是
A.Na+、Fe3+、SO42- B. Na+、SO42-、CO32-
C.Ca2+、Br-、SO42- D. CO32-、Cl-、SO42-
5.(2010天津高考改编)下列各表述与示意图一致的是
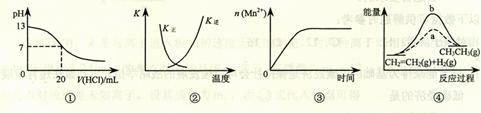
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);ΔH<0使用催化剂时,反应过程中的能量变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com