
题目列表(包括答案和解析)
10.(15分)
(1)①0.0030mol·L-1·min-1(2分,单位1分) ②<(1分) 2.25×10-4(2分) ③减小(1分)
(2)④< <(各1分共2分) ⑤BC(2分)
 ⑥A(每空1分共3分)
B.(曲线1、压强 1共2分)
⑥A(每空1分共3分)
B.(曲线1、压强 1共2分)
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
ⅰ |
|
|
|
|
ⅱ |
150 |
1/3 |
|
|
ⅲ |
|
1/3 |
|
9. (14分)
(1)①碳;铁(各1分) ②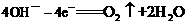 (2分)
(2分)
③ (1分);0.4(2分)
(1分);0.4(2分)
(2)①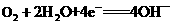 (2分)②试纸开始变蓝,一段时间后蓝色褪去(1分)
(2分)②试纸开始变蓝,一段时间后蓝色褪去(1分)
③13(2分) ④E;不能(各1分)
8.(1 4分)
(1)①(2分)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
②(1分)Na2S2O3在酸性溶液中不能稳定存在
(2分)打开K2,关闭K1
③(2分)漏斗、玻璃棒、烧杯
④(1分)NaOH
(2分)在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染
(2)①(2分)加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变
②(2分)90.2%
11.(15分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。

已知:
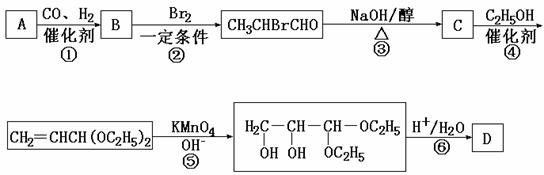
请回答下列问题:
(1)写出下列物质的结构简式:ww.k@s@5@ 高#考#资#源#网
B:____________;C:_____________;D:___________。
(2)指出反应②的反应类型______________________。
(3)写出反应③的化学方程式___________________________________________。
(4)反应④的目的是___________________________________________________。
(5)化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D’生成E和F的化学方程式:
D’→E:_________________________________________________________。
D’→F:__________________________________________________________
备注:本题根据江苏省金陵中学2008年测试题改编
ww.k@s@5@ 高#考#资#源#网 2011年高考模拟试卷3化学参考答案及评分标准
10.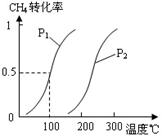 (15分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(15分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为
100L),在一定条件下发生反应:CH4(g)+H2O(g)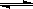
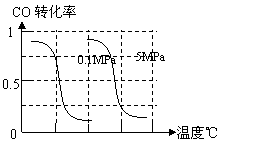
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 _。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) 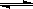 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H0,△S 0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.再充入1mol CO和3mol H2 D.充入He,使体系总压强增大
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
ⅰ |
150 |
1/3 |
0.1 |
|
ⅱ |
|
|
5 |
|
ⅲ |
350 |
|
5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。

注:本题根据温州市2010年一模试题改编
9.(14分)下图中甲、乙是电化学实验装置图,丙是氯碱工业生产示意图。

(1)若甲、乙两装置的烧杯中均盛有 溶液,反应一段时间后:
溶液,反应一段时间后:
①表面有红色物质析出的电极是:甲装置中的 棒,乙装置中的 棒。
②乙装置中碳棒表面发生的电极反应式是 。
③若起始时乙中盛放100 mL  溶液(25
溶液(25 ,pH=5),一段时间后溶液的pH变为1,要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入
,质量约为
g。
,pH=5),一段时间后溶液的pH变为1,要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入
,质量约为
g。
(2)若甲、乙两装置的烧杯中均盛有饱和NaCl溶液;
①写出甲装置中碳棒表面发生的电极反应式: 。
②已知: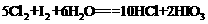 ,将湿润的淀粉KI试纸放在乙装置的碳棒附近,现象为
。
,将湿润的淀粉KI试纸放在乙装置的碳棒附近,现象为
。
③若乙装置转移 后停止实验,烧杯中溶液的体积为200 mL(25
后停止实验,烧杯中溶液的体积为200 mL(25 ),则此时溶液的pH= 。(不考虑电解产物的相互反应)
),则此时溶液的pH= 。(不考虑电解产物的相互反应)
④工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置, 的移动方向如图中标注,则
的移动方向如图中标注,则 的出口是
(填“C”、“D”、“E”或“F”);能否将阳离子交换膜换为阴离子交换膜 (填“能”或“不能”)。
的出口是
(填“C”、“D”、“E”或“F”);能否将阳离子交换膜换为阴离子交换膜 (填“能”或“不能”)。
备注:本题根据江西省重点中学2010届理综化学试题改编ww.k@s@5@ 高#考#资#源#网
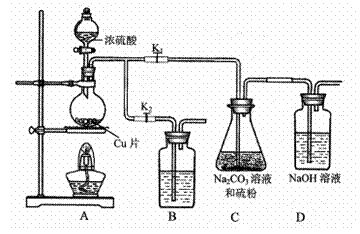
8.(14分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
 ww.k@s@5@
高#考#资#源#网
ww.k@s@5@
高#考#资#源#网
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是 。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32-+I2=S4O2-6+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。
|
编号 |
1 |
2 |
3 |
4 |
|
溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
|
消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
①判断达到滴定终点的现象是 。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数) 。
备注:本题根据北京市西城区2010年抽样试题改编
7.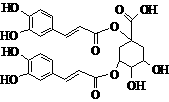 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
A.1mol洋蓟素最多可与11mol H2反应
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与5mol NaOH反应
备注:本题根据江苏盐城市2010年一模试题改编
6.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法正确的是
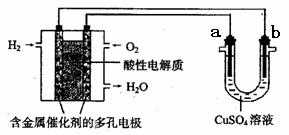
A.燃料电池工作时,正极反应为O2 + 2H2O +4e- =4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
备注:本题根据北京东城区2010年抽样试题改编
5.化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:

有关上述曲线图的说法正确的是
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化ww.k@s@5@ 高#考#资#源#网
B.曲线图②可以表示向一定量的硫酸溶液中滴加一定浓度的氢氧化钠溶液时pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
备注:本题根据上海市闵行区2010届调研考试改编
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com