
题目列表(包括答案和解析)
9、(15分)(2011年浙江省学军等三校高三联考理科综合试卷 改编)相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g) 2HI(g),实验测得起始、平衡时的有关数据如下表所示:
2HI(g),实验测得起始、平衡时的有关数据如下表所示:
|
容器编号 |
起始时各物质的物质的量(mol) |
达平衡时体系的变化 |
||
|
I2 |
H2 |
HI |
||
|
① |
1 |
3 |
0 |
放出热量:Q1=23.15kJ |
|
② |
0.8 |
2.8 |
0.4 |
平衡时碘化氢的体积分数为20% |
|
③ |
0 |
4 |
4 |
|
|
④ |
2 |
3 |
0 |
|
(1)下列叙述正确的是 ▲
A.四个容器中反应的平衡常数相等
B.反应的热化学方程式为:H2(g)+I2(g) 2HI(g) △ H =23.15kJ/mol
2HI(g) △ H =23.15kJ/mol
C.平衡时,容器④中H2的转化率高于① D、容器②中达平衡时放出的热量Q2<23.15kJ
E、达到平衡后若将容器①的体积变为0.25 L,H2的转化率提高
(2)该温度下,在容积为1L密闭容器③中发生反应建立平衡,若达到平衡所需的时间为2min,则平均反应速率v(HI)= ▲ ,该温度下,反应H2(g)+I2(g) 2HI(g)的平衡常数 K= ▲ 。
2HI(g)的平衡常数 K= ▲ 。
(3)平衡常数K只受温度的影响,与浓度、压强等因素无关,故可利用平衡常数来判断平衡是否移动及移动的方向。例如,若③为一个装有可移动活塞的容器,上述平衡达成后用外力将活塞向内推至容积为0.5L并恢复原温度,则由于
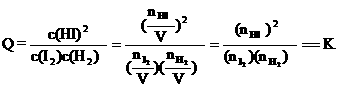 ,
,
可判断平衡将 ▲ (填“正向”、“逆向”或“不”)移动。
(4)如果保持温度和压强不变,向③的平衡体系中加入1.6molI2,平衡将 ▲ (填“正向”、“逆向”或“不”)移动,理由是 ▲ 。
8、(14分)(浙江省舟山三中2010年高三摸底考试 改编)短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍, A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ▲ ,E的原子结构示意图是__▲___,
下列可以验证C与D两元素原子得电子能力强弱的实验事实是___▲_______(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 ▲ 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ▲ ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 ▲ 。
(4)由A、C、E三种元素组成的化合物C2A6E2是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出该化合物第一步水解的离子反应方程式 ▲ ____________________。
(5)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该过程的总离子方程式____ ▲ 。ww.k@s@5@ 高#考#资#源#网
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为 ▲ 。
7、 (2009·福建理综,11改编) 将反应2Fe3++2I-
(2009·福建理综,11改编) 将反应2Fe3++2I-
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
A.反应开始时,乙中石墨电极上发生氧化反应
B.电流计读数为零时,达到化学平衡状态
C.乙池中若换为Fe电极和FeCl2溶液,则电流计指针向相反方向偏转
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极仍为正极
6、 (原创)对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图,下列说法不正确的是
(原创)对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图,下列说法不正确的是
A.对羟基肉桂酸的化学式为:C9H8O3
B.对羟基肉桂酸可以发生氧化、取代、酯化、加聚、缩聚反应ww.k@s@5@ 高#考#资#源#网
C.对羟基肉桂酸既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.对羟基肉桂酸分子中最少有4个碳原子共线,最多所有原子都可能共面
5、 (原创)下列溶液说法正确的是
(原创)下列溶液说法正确的是
A、常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO-3)+3c(CO2-3)+3c(H2CO3)
B、(2010天津卷)图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C、(2010 全国卷)1.0*10-3mol/L盐酸的pH=3.0,1.0*10-8mol/L盐酸的pH=8.0
D、分别将等体积的等pH的醋酸和盐酸加水稀释100倍,所得溶液的pH:③>④
3、(2011年三月浙江金华、丽水、衢州十二校联考 改编)下列离子方程式的评价正确的是
|
化学用语 |
评价 |
|
A.在碳酸氢镁溶液中加入过量氢氢化钠溶液:Mg2++2HCO3-+2OH-=Mg CO3↓+CO32-+2H2O |
错误:生成物应是Mg(OH)2和Na2CO3 |
|
B.在亚硫酸氢钠中加入少量的次氯酸钠溶液 SO32-+ClO-+H2O= Cl-+2H++SO42- |
正确 |
|
C. 亚磷酸是一种二元酸,在其中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2O |
正确 |
|
D.在过氧化钠中加入稀硫酸: N a2O 2+2H+=2Na++H2O+O2↑ |
正确 |
ww.k@s@5@ 高#考#资#源#网4、(原创)下列实验操作能够实现的是
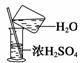
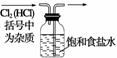
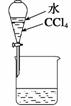
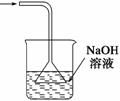
A、浓硫酸的稀释 B、除去氯气中的杂质 C、分离水和四氯化碳D、吸收氯化氢尾气
2、(原创)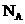 表示阿伏伽德罗常数,下列判断正确的是
表示阿伏伽德罗常数,下列判断正确的是
A、(2010莆田模拟)常温下,1L0.1mol/L的 溶液中铵根离子为0.1
溶液中铵根离子为0.1
B、(2009 江苏卷)室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
C、(2009·广东改编)22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA
D、(2010·福建)含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
1、(原创)化学与生产、生活、社会密切相关,下列有关说法不正确的是:
A、乙醇汽油是混合型能源,乙醇可由富含淀粉的谷物发酵产生
B、世博停车场安装催化光解设施,可将汽车尾气中的CO和NOx反应生成无毒物质
C、实行“汽车下乡”政策、大力推广使用家用小轿车有利于节能减排
D、废电池要集中处理,防止其中的重金属盐对土壤和水源造成污染
11.某种药物(P)的合成路线如下:[根据江苏盐桥中学高考模拟试题第18题改编]
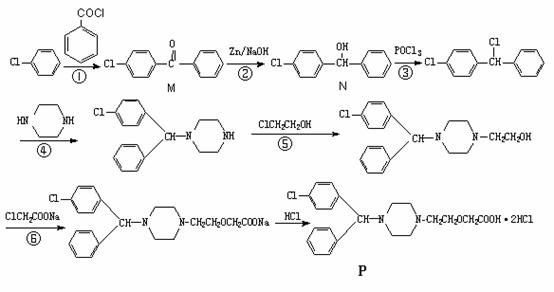
(1)上述反应中,属于取代反应的是 ▲ (填序号).
(2)物质M核磁共振氢谱有 ▲ 个峰。
(3)该种药物中含氧官能团是 ▲ (写名称)。
(4)反应④中会产生一种含氮副产物,最有可能是 ▲ 。
(5)图中物质N符合下列条件的异构体有 ▲ 种。
①能与氯化铁溶液发生显色反应 ②含有-CH2Cl ③含有联苯( )结构。
)结构。
(6)抗血栓药氯吡格雷的手性合成如下:
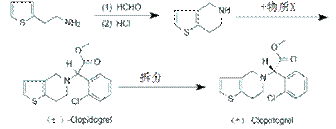
已知X的分子式为:C9H8Cl2O2,则X的结构式为 ▲ 。氯吡格雷中手性碳原子数目为 ▲ 个。
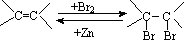
(7)已知:

中药材大青叶的提取物 (紫苏醛)和甲醇为原料合成(紫苏
酸甲酯) 的路线如下,请补充完整。

10.混合物A由白色和黑色固体组成,可以发生如下框所示的一系列变化:[根据江苏省黄桥中学高三期中试题第21题改编]


(1)写出反应③的化学方程式: 。
反应④的离子方程式: 。
(2)操作②的名称是 。
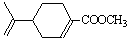
(3)下列实验装置中可用于实验室制取气体G的发生装置是 (填序号)。
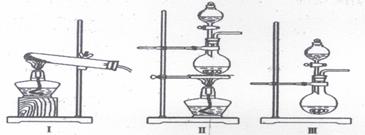
为了得到纯净干燥的气体G,可将气体通入a和b装置,a、b两广口瓶中所装入的溶液依次是a: ,b: 。

(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出d中发生反应的的离子方程式: ;
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e-i装置中,可用于吸收J的
是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com