
题目列表(包括答案和解析)
8.(14分)(北京市海淀区2010高三第一学期期末20题改编)W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3∶8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
(1)W的单质是一种___▲__色晶体。写出X的氢化物的电子式 ▲
Z单质的晶体类型是___▲__类型
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是_____▲_________。(用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似)。
(3)已知A、B、C、D四种物质存在如下反应关系:
A+B―→C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是________▲________。ww.k@s@5@ 高#考#资#源#网
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是_____▲_____。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是_______▲___________。
7. 某无色溶液中可能含有 ①Na+、②Ba2+、③Cl-、④Br-、⑤、SO42-⑥SO32-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:(绍兴一中2010期中考试20题改编)ww.k@s@5@ 高#考#资#源#网
|
步骤 |
操作 |
现象 |
|
1 |
用pH试纸检验 |
溶液的pH大于7 |
|
2 |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
3 |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
4 |
过滤,向滤液中加入AgNO3溶液 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑥ B.不能确定的离子是①
C. 肯定没有的离子是②⑤ D.不能确定的离子是③⑤
第Ⅱ卷
6. 下列关于实验原理或操作的叙述中,正确的是(原创)
A.除去乙酸乙酯中的乙酸:加入乙醇和浓硫酸,共热,使乙酸全部转化为乙酸乙酯
B.液态溴乙烷中加入NaOH溶液共热几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验溴乙烷中含溴元素
C.在海带中提取碘的实验中既可以用四氯化碳作萃取剂也可以用酒精作萃取剂
D.检验甲酸中是否混有乙醛:可向样品中加入足量稀NaOH溶液中和甲酸后,再做银镜反应实验
4. 下列说法正确的是(原创)
A.在Na2O2晶体中阳离子与阴离子的物质的量之比为l:1
B.离子晶体中一定含有金属阳离子
C.水加热到很高的温度都难以分解是因为水分子间存在氢键
D.用鸡蛋壳内膜和蒸馏水可以除去淀粉胶体中的食盐
|
 A.用铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu+4H++O2↑
A.用铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu+4H++O2↑
B.硫酸氢钠溶液中加入氢氧化钡至溶液呈中性:H++SO42-+Ba2++OH-==BaSO4↓+H2O
C.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O
D.向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO
3.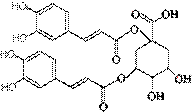 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物, 其结构如下图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)(2010四川成都高考模拟6题改编)
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物, 其结构如下图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)(2010四川成都高考模拟6题改编)
A. 洋蓟素的分子式是C25H19O12
B.不能与氯化铁溶液发生显色反应
C.1 mol洋蓟素最多可与11 mol NaOH反应
D.一定条件下能发生酯化反应和消去反应
2. 用NA表示阿伏加德罗常数的值,下列说法正确的是(原创)
A.在铜与硫的反应中,1 mol铜失去的电子数为2 NA
B. 0.1 mol OH-含NA个电子
C. 1.8 g重水(D2O)中含NA个中子
D. 标准状况下11.2 L臭氧中含NA个氧原子ww.k@s@5@ 高#考#资#源#网
1. 化学与生产、生活密切相关,下列叙述不正确的是(原创)
A. 食品保鲜膜按材质分为聚乙烯、聚氯乙烯,它们都属于链状高分子,受热易熔化
B. 食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
C. 人造纤维、合成纤维和光导纤维都是有机高分子化合物,符合Cn(H2O)m的组成
D. 控制含磷洗涤剂的使用,为了防止水体富营养化,保护水资源
10、[改编浙江省新高考研究联盟2011届第一次联考]
Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料。ww.k@s@5@ 高#考#资#源#网
实验室以MnO2为原料制备少量高纯MnCO3 的操作步骤如下:
(1)制备MnSO4溶液:
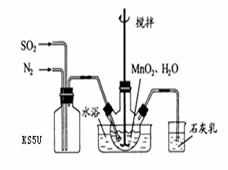 在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入 SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入 SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知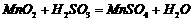 )。
)。
①石灰乳作用 。
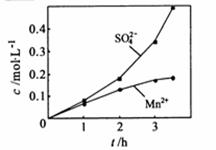 ②若实验中将
②若实验中将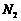 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7, 请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
① ;② ;③检验SO42-是否被洗涤除去;④ ;⑤低于100℃干燥。
Ⅱ 锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3-4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
(1)判断步骤②滴定终点的方法是 。
(2)计算合金中Cu的质量分数 .
[改编2011萧山中学三月月考]11.(15分)芳香族化合物A(化学式为(C9H9BrO2)在一定条件下有如下的转化关系,其中1mol C与Na完全反应生成1 mol H2,若与NaHCO3完全反应也能产生1mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。
(1)C的分子式 ,
A、D、G的结构简式A 、D 、G ;
(2)用核磁共振氢谱可以证明化合物B中有_______种氢处于不同的化学环境。
(3)反应⑤的化学方程式 ;
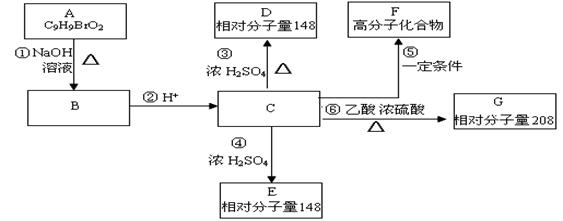
已知R物质属于C的同分异构体,其性质如下:
(4)若R的苯环上一卤代物有两种,R的结构简式为 ;
(5)若R的苯环上一卤代物有三种,R的结构简式 (任写一种)。
ww.k@s@5@ 高#考#资#源#网
11、(14分)(步步高专题复习与增分策略 )已知A的分子式为C3H4O2,下图是A-H间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物。(提示:羟基与双键碳原子相连的醇不存在;同一个碳原子上连有2个或多个羟基的多元醇不存在)请填写下列空白:
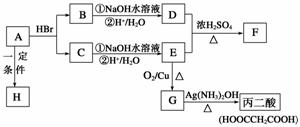
(1)A中含有的官能团有(写结构简式) ▲ 。
(2)请写出下列有机物的结构简式:
C ▲ ;F ▲ 。
(3)请指出下列反应的反应类型:A-→B ▲ ; C-→E ▲ 。
(4)G中不同化学环境的氢原子有 ▲ 种。
(5)请写出下列反应的化学方程式:
①A-→H ▲ ;
②B-→D(第①步)__ ▲ 。
ww.k@s@5@ 高#考#资#源#网
10、(15分)(董君老师公开课 改编)补铁药物“速力菲”说明书部分内容摘录:
[规格]每片含琥珀酸亚铁0.1g
[组成与性状]内含Fe2+34.0%-36.0%的无水碱式盐,为薄膜糖衣片
[适应症]用于缺铁性贫血症预防及治疗
[用量用法]成人预防量0.1g/日,治疗量0.2g-0.4g/日;小儿预防量30-60mg/日,治疗量0.1g-0.3g/日
[储藏]在避光、密封、阴凉处保存
[药物相互作用]与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案:ww.k@s@5@ 高#考#资#源#网
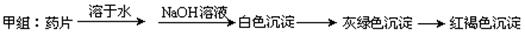 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因: ▲ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:

(2)若试剂1为盐酸;则试剂2为 ▲ 。加入试剂2后,溶液为什么显示淡红色? ▲
加入双氧水溶液后,为什么红色加深? ▲
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
① [Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② ▲
(3)请你对其中一种可能进行实验验证:
实验方案(用文字叙述): ▲ ,根据预期现象判断结论: ▲
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
|
序号 |
V(KMnO4)初 |
V(KMnO4)终 |
V(KMnO4) |
|
1 |
2.24mL |
14.25mL |
12.01mL |
|
2 |
0.30mL |
12.72mL |
12.42mL |
|
3 |
0.50mL |
12.53 |
12.03mL |
计算:该补血药中含Fe2+的质量分数 ▲ (保留小数点后二位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com