
题目列表(包括答案和解析)
6、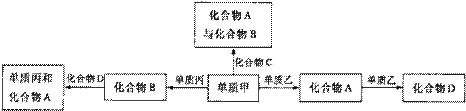 化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体一定是分子晶体
D.上图所示的五个转化关系中,均为氧化还原反应
5、下列实验操作完全正确的是( )
|
编号 |
实 验 |
操 作 |
|
A |
钠与水的反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的氯化钾溶液1 000 mL |
准确称取氯化钾固体,放入到1 000 mL的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
取出分液漏斗中所需的上层液化 |
下层液体从分液漏斗下端管口入出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
4.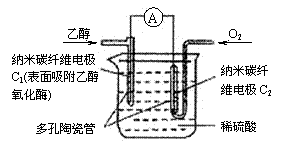 生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是(
)
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是(
)
A.放电一段时间后,C2极周围的pH升高
B.C2极的电极反应式为: O2+4H++4e-=2H2O
C.该生物燃料电池的总反应方程式为:
C2H5OH+3O2=2CO2+3H2O
D.电子由C2极经外电路导线流向C1极
3、下列各组离子在指定溶液中一定能大量共存的是 ( )
①加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl-、S2-
②使pH=11的溶液中:Na+、AlO2-、NO3-、SO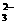 、SO
、SO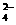
③由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、HCO3-、NO3-、NH4+、F-
④澄清透明溶液中: MnO4-、NH4+、Cl-、K+、SO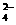
⑤使紫色石蕊试液变红的溶液: Fe2+、Mg2+、NO3-、Cl-、SO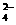
A.③④ B.②④ C.①② D.③⑤
2、下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小
B.25℃时,pH=7的氨水和硫酸铵的混和溶液中,c(NH4+)=c(SO42-)
C..pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
1、下列关于工业生产说法不正确的是( )
A.电解精炼铜时,用粗铜做阴极,纯铜做阳极
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在炼铁工业,需要的原料有铁矿石、焦炭、空气、石灰石等
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
11.(14分)根据图示回答下列问题:
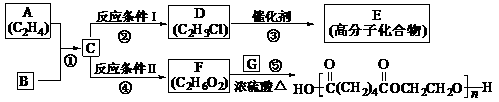
(1)写出A、E、G的结构简式:
A , E , G ;
(2)反应②的化学方程式(包括反应条件)是:
反应④化学方程式(包括反应条件)是:
(3)写出①、⑤的反应类型:① ⑤
10.(16分)运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源ww.k@s@5@ 高#考#资#源#网
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式_________________ ____________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
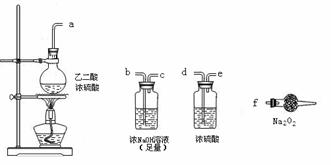
|
已知:H2C2O4====== CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为 ________ ;若CO能够与Na2O2发生反应,则预测反应产物为____________。
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5
kJ·mol -1 ;CO(g)+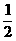 O2(g)=CO2(g),△H=-283.0
kJ·mol -1,写出CO2 和C(s)反应的热化学方程式___________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H=-283.0
kJ·mol -1,写出CO2 和C(s)反应的热化学方程式___________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
9.(18)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
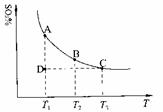
 ①2SO2(g)+O2(g)
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
移动(填“向左”、“向右”或“不”);
①2SO2(g)+O2(g)
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,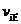
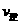 (填“>”、“<”或“=”)ww.k@s@5@
高#考#资#源#网
(填“>”、“<”或“=”)ww.k@s@5@
高#考#资#源#网
 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农
业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成
1molNH3过程中能量变化示意图,请写出工业合成氨
的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1
的氨水与b mol·L-1的盐酸等体积混合,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成,从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时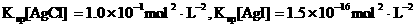 )
)
8.(10分)表是元素周期表的一部分,表中所列的字母分别代表某一元素.

(1)1 mol A与足量D的氢化物完全反应产生的气体在标准状况下的体积为________.
(2)写出B的最高价氧化物的电子式________.
 (3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化:ww.k@s@5@
高#考#资#源#网
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化:ww.k@s@5@
高#考#资#源#网
其中化合物M是一种白色胶状沉淀,则M为(填化学式)________;K的溶液与B的某种氧化物反应的化学方程式为______________________________;一种新型无机材料由G元素和C元素组成,其化学式为____________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com