
题目列表(包括答案和解析)
17.(5分)
下表为元素周期表的一部分,请回答有关问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是 和 ;
(2)表中最活泼的金属是
,非金属最强的元素是  ;
;
(填写元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:
, ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
。
16. (14分)有M、A、B、D、N、E五种短周期元素,
(14分)有M、A、B、D、N、E五种短周期元素,
原子序数依次增大。M元素的单质是自然界最轻
的气体,N元素的原子半径是所在周期原子半径最大的。
A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之
和为37。试回答:
(1)A、B、D、E四种元素分别与M元素形成的简单化合物中,沸点最高的是_______(填化学式)。
(2)M、D、E、N形成的简单离子的半径由大到小的关系是(写离子符号)_____________________。
(3)A、B、D、M可组成多种18电子分子,请写出1种具有18电子的有机物的分子式____________。
(4)由A、D、N三种元素组成的无机物,其水溶液呈碱性,用离子方程式表示其原因 。
(5)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为 。
(6)在由M 、D、N、E四种元素构成的化合物的水溶液中滴入少量的Ba(OH)2溶液,写出可能发生的所有反应的离子方程式 。
15.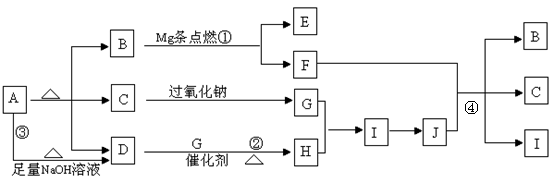 (15分)图中A-J分别代表一种反应物或生成物,已知A受热分解得到等物质的量的B、C、D气态物质,图中部分生成物未列出
(15分)图中A-J分别代表一种反应物或生成物,已知A受热分解得到等物质的量的B、C、D气态物质,图中部分生成物未列出
请回答:
(1)B的结构式 , D分子的空间构型为 ;
(2)写出反应①、④的化学方程式
① ;
④ ;
(3)写出反应③的离子方程式
 ;
;
(4)写出有C参加的且C只做还原剂的氧化还原反应化学方程式 ;
(5)将D和G以1:2混合在催化剂的作用下充分反应后无气体剩 余,则生成溶液中溶质的质量分数
(用分数表示)。
余,则生成溶液中溶质的质量分数
(用分数表示)。
14.(14分)已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,D为气体单质,E为黑色粉末。右图转化关系中E均起催化作用(某些产物已略去)。则:
(1)A的化学式为 ;B分子的电子式为 ;
(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X。
甲同学为探究该气体的性质,设计了如下图装置(III中夹持装置已略去)。
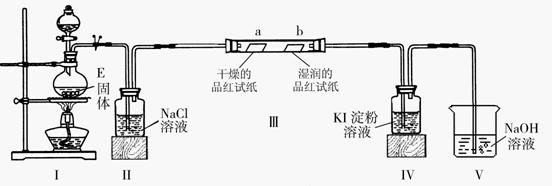
①I中发生反应的离子方程式为 ;
②实验开始不久,观察到装置IV中的现象为 ;
③实验结束后,该同学在装置III中观察到b的红色褪去,而没有出现“a无明显现象”这一预期现象。为达到实验目的,他在装置 (填装置序号)之间又添加了洗气瓶,该装置的作用是 ;
(3)将气体X通入到紫色的石蕊试液中,观察到的现象是 ;
(4)气体X能与溶液B反应,生成气体D,试写出该反应的化学方程式:
。
13.阿伏加德罗常数约为6.02×1023mol-1。下列叙述正确的是( )
A. 1L0.1mol/L的FeCl3溶液中,Fe3+的数目约为6.02×1022
B. 7.8gNa2O2中含有的阴离子数目约为6.02×1022
C. 1mol金刚石中含有C-C键的数目约为6.02×1023
D. 标准状况下,1L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)×6.02×1022
第Ⅱ卷(必考题4 8分)
8分)
12.向100mL0.25mol/L的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是
A.3.45g B.2.3g C.1.15g D.0.575g
11.下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Ca2+、Fe2+、NO3-、Cl- B.K+、Mg2+、HCO3-、PO43-
C.Ba2+、Na+ 、I-、NO3- D.Na+、K+、SO42-、SO32-
10. 下列说法正确的是
A.非金属元素组成的化合物一定是共价化合物。
B.离子化合物的熔点一定比共价化合物的高。
C.元素周期律是元素的性质随元素相对原子质量的递增发生周期性递变的规律。
D.含有阴离子的化合物一定含有阳离子
9. 下列叙述正确的是
A.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物。
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱。
C.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳。
D.一定条件下,浓醋酸在稀释过程中导电能力逐渐减弱。
8. 16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A.16O2与18O2互为同分异构体。
B.16O与18O核外电子排布方式不同。
C.通过化学变化可以实现16O与18O间的相互转化。
D.标准状况下,1.12L 16O2和1.12L 18O2均含0.1NA个氧原子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com