
题目列表(包括答案和解析)
13.a gMg-Al合金完全溶解在c1 mol/L、V1LHCl溶液中,产生bmolH2。再向反应后的溶液中加入c2mol/L、V2LHCl溶液,恰好使沉淀达到最大值,且沉淀质量为dg。下列关系不正确的是( )
A.d=a+34b B.c1V1=c2V2 C.Al的质量(24b-a)/9 g
D.与金属反应后剩余HCl为(c1V1-2b)mol
第II卷 (共58分)
12. 下图装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图。装置(Ⅰ)的离子交换膜只允许Na+通过。已知充、放电的化学反应方程式为2Na2S2+NaBr3=Na2S4+3NaBr。当闭合开关K时,X极附近溶液先变红色。下列说法正确的是( )
下图装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图。装置(Ⅰ)的离子交换膜只允许Na+通过。已知充、放电的化学反应方程式为2Na2S2+NaBr3=Na2S4+3NaBr。当闭合开关K时,X极附近溶液先变红色。下列说法正确的是( )
A.闭合K时,Na+从右到左通过离子交换膜
B.闭合K时,负极反应为3NaBr-2e-=NaBr3 +2 Na+ www.k@s@5@ 高#考#资#源#网
C.闭合K时,当有0.1 mol Na+通过离子交换膜,
X电极上析出标准状况下气体1.12 L
D.闭合K时,X电极的电极反应式为2Cl--2e-=Cl2↑
11.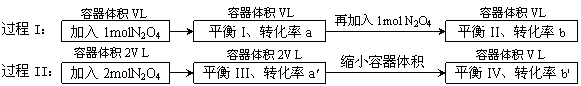 若过程I与过程II温度相同,则关于反应N2O4(g)
若过程I与过程II温度相同,则关于反应N2O4(g) 2NO2
(g)在下列过程中发生的变化描述正确的是( )
2NO2
(g)在下列过程中发生的变化描述正确的是( )
A. a' < b'、a > b B.在平衡I向平衡II过渡的过程中,v(逆) < v(正)
C.a' > a、b' < b D.平衡II与平衡IV中N2O4的质量分数相等
10.下列说法正确的是( )
A.相同温度下,已知HF比HCN易电离,则NaF溶液的PH比NaCN溶液的PH大
B.常温下0.4mol/LHB溶液 和0.2mol/LNaOH溶液等体积混合后溶液的PH=3则溶液中微粒浓度存在下面关系:c(HB)>c(Na+)>c(B-)> c(H+) >c(OH-)
C.常温下0.1mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3·H2O、④CH3COONH4溶液中c(NH4+)由大到小的顺序是:②>①>④>③
D. 用惰性电极电解含有一定浓度的CuSO4溶液, 一段时间后需加入0.1molCu(OH)2才可以恢复至原来的浓度和体积,则在电解过程中转移了0.4mol电子
9.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。则X为( )
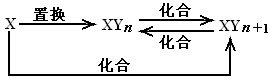
A.当n=1时,X可能是Mg B.当n=1时,X可能是N2
C.当n=2时,X可能是S D.当n=2时,X可能是Fe
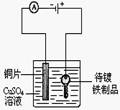
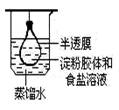
8.根据实验目的判断下列实验操作或装置正确的是( )
|
目的 |
实验室制O2 |
配制稀硫酸溶液 |
在铁制品上镀铜 |
净化、精制淀粉胶体 |
|
装置 或 操作 |
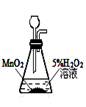 |
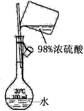 |
 |
 |
|
选项 |
A |
B |
C |
D |
7.下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO4-、SO42- ②pH=11的溶液中:CO32-、Na+、NO3-、AlO2-
③加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤在溶液中能大量共存,加入NaOH后加热既有气体放出又有沉淀生成的溶液:
Ca2+、HCO3-、NH4+、AlO2-
⑥能使酚酞变红色的溶液:Na+、C1-、S2-、SO32- www.k@s@5@ 高#考#资#源#网
A.①③⑤ B.②④⑤ C.②④⑥ D.④⑤⑥
28、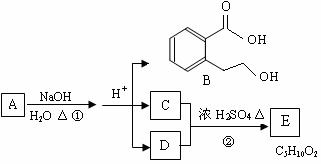 (14分)下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
(14分)下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
根据右图回答问题:
(1)C分子中的官能团名称是:
______________;下列反应中,化合物B不能发生的反应是 (填字母序号):
a 加成反应 b取代反应 c消去反应
d酯化反应 e水解反应 f 置换反应
(2)反应②的化学方程式是_________________ _。
(3)A的结构简式是 __________________ 。
(4)同时符合下列三个条件的B的同分异构体的数目有 个。
Ⅰ.含有间二取代苯环结构 Ⅱ.属于非芳香酸酯 Ⅲ.与 FeCl3 溶液发生显色反应。
写出其中任意一个同分异构体的结构简式
(5)常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液pH如下表:
|
实验编号 |
C物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
|
m |
0.1 |
0.1 |
pH=9 |
|
n |
0.2 |
0.1 |
pH<7 |
从m组情况分析,所得混合溶液中由水电离出的c(OH-)= mol·L-1。
n组混合溶液中离子浓度由大到小的顺序是 。
www.k@s@5@ 高#考#资#源#网
27、(14分)为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将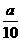 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。请回答下列问题:
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O www.k@s@5@ 高#考#资#源#网
(2)在滴定实验中不能选择 式滴定管。
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和 ;
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一不准确理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
26. (14分)在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2 + 3H2 2NH3,,平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
(14分)在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2 + 3H2 2NH3,,平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
(1)通过计算说明起始充入N2和H2的物质的量分别为:x = _________,y = __________。平衡后NH3的体积分数
(2)写出该反应的热化学方程式__________________。
(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该 18.4 kJ(填大于、小于或等于)。
(3)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同。
①若c = 2,在相同的条件下达平衡时,该反应吸收的热量为_________kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com