
题目列表(包括答案和解析)
12. 八角茴香含有一种抗禽流感病毒的重要成分--莽草酸,其结构简式为:
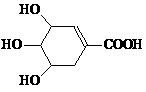 ,则莽草酸不具有的性质是
,则莽草酸不具有的性质是
A. 遇FeCl3溶液呈紫色 B. 能发生消去反应
C. 能与H2发生加成反应 D. 1 mol莽草酸只能与1 mol NaOH反应
11. 常温下,对于物质的量浓度相等、体积相同的NaCl溶液与NaF溶液,下列判断错误的是
A. 在NaCl溶液中一定有c(Na+)+c(H+)=c(OH-)+c(Cl-)
B. 在NaF溶液中一定有c(Na+)+c(H+)=c(OH-)+c(F-)
C. NaCl溶液中的氢离子浓度 比NaF溶液中的氢离子浓度大
D. 由于F-水解,NaF溶液中每减少n mol F-,必然增加n mol OH-
10. 56 g Fe粉投入500 g稀HNO3中,两者恰好完全反应放出NO,溶液增重26 g,则反应后溶液中的金属阳离子
A. 只有Fe3+ B. 只有Fe2+ C. 有Fe2+ 和Fe3+ D. 无法确定
9. 已知酸性: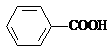 >H2CO3>
>H2CO3>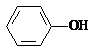 ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将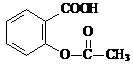 转变为
转变为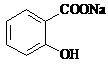 的最佳方法是
的最佳方法是
A. 与稀H2SO4共热后,加入足量的NaOH溶液 www.k@s@5@ 高#考#资#源#网
B. 与稀H2SO4共热后,加入足量的NaHCO3溶液
C. 与足量的NaOH溶液共热后,再通入足量CO2
D. 与足量的NaOH溶液共热后,再加入适量H2SO4
8. 氟气是氧化性最强的非金属单质。等物质的量的F2与NaOH在稀溶液中反应生成NaF、H2O和一种气体,该气体是
A. HF B. OF2 C. H2 D. O2
7. 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则
A. N4的熔点比P4高 B. 1 mol N4气体转化为N2时要吸收748 kJ能量
C. N4是N2的同系物 D. 1 mol N4气体转化为N2时要放出724 kJ能量
28.(14分)某有机物甲和A互为同分异构体, 经测定它们的相对分子质量小于100;将1mol甲在O2中充分燃烧得到等物质的量的CO2和H2O (g ) ,同时消耗112LO2(标准状况);在酸性条件下将1 mol甲完全水解可以生成1 mol 乙 和1mol丙 ;而且在一定条件下,丙可以被连续氧化成为乙。
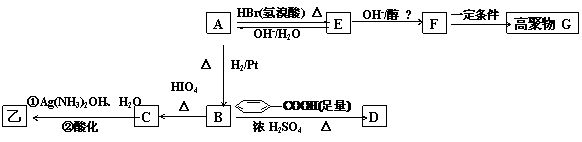

(1)请确定并写出甲的分子式 ;与甲属同类物质的同分异构体共有 种(包含甲)。 www.k@s@5@ 高#考#资#源#网
(2)经红外光谱测定,在甲和A的结构中都存在C=O双键和C-O单键,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
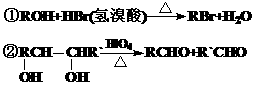
(3)E → F 的反应类型为 反应 ;
(4)A 的结构简式为 ;G 的结构简式为 ;
(5)B →D的反应化学方程式为: _ ;
(6)写出C在条件①下进行反应的化学方程式: 。
27.(16分) 某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性
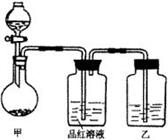 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,请指出:______________________。
(2)写出装置甲中反应的化学方程式 。
(3)装置乙中的试剂是 。
[实验二]探究某硫酸亚铁盐固体是否变质
(4)请你帮助该同学完成如下实验方案:
|
实验操作 |
预期现象和结论 |
|
|
|
[实验三]用KHSO4制取H2O2并测其质量分数
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
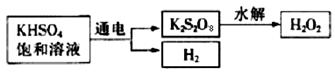
该同学用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数。
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是________________________________。
(7)写出该滴定反应的离子方程式: 。
(8)原H2O2溶液中溶质的质量分数为_________________________________________。
26.(14分)中学化学中常见的物质有如下图所示的转化关系(反应条件略去)。X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸。
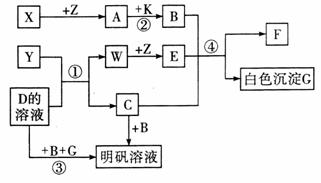
(1)写出下列物质的化学式: www.k@s@5@ 高#考#资#源#网
Y 、A 、C 。
(2)D的电子式为 。
(3)我国生产B的工业中,常采用以下方式处理尾气A:
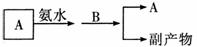
试从综合经济效益的角度分析,这样处理的目的是(答出其中两点即可):
a. ;b. 。
(4)反应①的化学方程式: 。
反应②的化学方程式: 。
反应④的离子方程式: 。
25.(14分)中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O(没有配平)。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
,鉴别这两种气体不能选用的试剂是
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是 。此时溶液中的离子按照浓度由大到小排列的顺序是 。
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色。若被还原的B物质的量为2mol时,间生C气体的体积是 ____ L(标况)。将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因 。
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一。C发生水解反应的离子方程式是
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阴离子的方法是
(简述操作过程及结论)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com