
题目列表(包括答案和解析)
9、下列叙述正确的是( )
①某元素的氢化物分子间能形成氢键,该元素非金属性一定是同一主族中最强
②某元素的一个原子得到一个电子达到稳定结构放出的能量越多,离子一定最难水解
③某离子晶体中含有非极性键,该晶体熔化时非极性键一定不被破坏
④电解质溶于水,是在电流作用下离解成自由移动的离子
⑤电解质溶液导电的过程,一定发生化学变化
A.①②③⑤ B.①⑤ C.①③⑤ D.①②③④⑤
8、若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,11.2升乙醇完全燃烧产生的CO2的 分子数为0.5NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为a/22.4NA
③60gSiO2晶体中含有2NA个Si--O键
④某条件下,将1mol N2和3mol H2在密闭容器中充分反应,生成NH3分子数为2NA
⑤7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
A.①④ B.②③ C.③⑤ D.②⑤ www.k@s@5@ 高#考#资#源#网
7、下列离子方程式正确的是( )
A、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
B、等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:

C. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:

27.(14分)工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ;
NH4HCO3+NaCl NaHCO3↓+NH4Cl ;2NaHCO3  Na2CO3+CO2↑+H2O高考资源
Na2CO3+CO2↑+H2O高考资源
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ,其作用是 ;
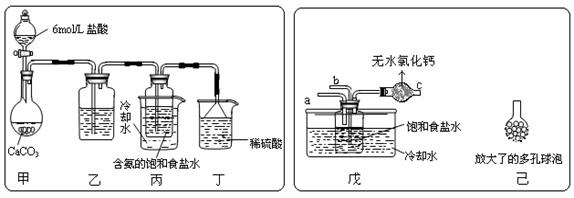 (Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称),该操作所需要的玻璃仪器有
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入_______气体,说明原因_________________________
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3) 碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为_______。
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:
26.(16分)有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)若X与Z元素形成ZX2化合物,则ZX2的电子式 ,其中含有的化学键有
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是
___________________________________________________________________
此液体具有的性质是______________________(填写序号字母)。
a. 光束通过该液体时形成光亮的“通路”
b. 插入电极通直流电后,有一极附近液体颜色加深
c. 向该液体中加入硝酸银溶液,无沉淀产生
d. 将该液体加热、蒸干、灼热后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2完全氧化放热98.0 kJ,写出该反应的热化学方程式 。若2mol该气体与1 molO2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为______ ____。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是
____________________________________________________________________。
(4)Y的最高价氧化物对应水化物的化学式是_________________
①常温下,将20mL0.1mol·L-1的该物质的水溶液与VmL0.1mol·L-1的氨水混合后pH=7,则V 20mL(填“>”“ <”或“ =”)
②常温下,将pH=2的该物质的水溶液V1mL与V2mL0.01mol·L-1的氨水混合后,溶液呈酸性,则V1与V2的关系满足 www.k@s@5@ 高#考#资#源#网
A.V1>V2 B.V1<V2 C.V1=V2 D.无法确定
此时溶液中带电微粒的浓度大小顺序可能为
(5)Z的高价硝酸盐溶液中滴加足量HI溶液的离子方程式:
25.(14分)A、B、C、D、E均为短周期元素,且原子序数逐渐增大。A、D最外层电子数相等且能形成离子化合物,A与B的质子数之和等于C的质子数,A+ 与 C2- 的核外电子数之和等于D+离子的核外电子数,B 原子与 D+ 离子的核外电子数之和等于 E 原子的核外电子数。
(1) B的元素符号为 ,E的原子结构示意图 ;由A、C、E三种元素组成的化合物具有漂白性,其电子式为 。
(2)将少量的D2C2投入到Na2S溶液中,产生浑浊现象,则反应的离子方程式为
。
(3)A、B、C三种元素可组成多种化合物,请写出两种水溶液呈酸性的化合物,其中甲物质促进水的电离 ,物质乙抑制水的电离 ;室温下,若两溶液的pH都为4,则两溶液中水电离的氢离子浓度比为:甲:乙= www.k@s@5@ 高#考#资#源#网
(4)A与B化合形成10电子化合物丙,A与E化合形成18电子化合物丁;常温下,pH=11的丙溶液与pH=3的丁溶液等体积混合后溶液的pH 7(填“>”“<”“=”),溶液中离子浓度由大到小的顺序为 。
(5)A2与C2可构成燃烧电池,若电解质溶液为KOH溶液,该电池的负极反应为
13. 如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是
如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是
A.A池为电解池,B池为原电池
B. D电极与E电极都发生氧化反应
C.F极是以粗铜板为材料作阳极
D.B池中E极质量增加25.6 g
第II卷 (共58分)
12. 某有机物的结构简式为,下列叙述正确的是( )
某有机物的结构简式为,下列叙述正确的是( )
A.该有机物属于芳香烃
B.该有机物能发生取代反应、加成反应、酯化反应、消去反应
C.该有机物1mol与足量NaOH溶液充分反应,消耗NaOH物质的量为4mol
D.该有机物中加入FeCl3溶液后,溶液呈紫色
11. A、B、C、D四种短周期主族元素,其原子序数依次递增,A元素的原子既能形成简单阳离子、又能形成简单阴离子;B、C、D核电荷数总和为25,且B与C两元素能形成BC、BC2两种常见的共价化合物。以下叙述不正确的是
A.原子半径:D>C>B>A
B B、C、D三种元素形成的化合物是离子化合物
C.B的单质有多种同素异形体
D.A、B、C、D四种元素中的三种形成的化合物溶于水,溶液可能呈酸性、中性或碱性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com