
题目列表(包括答案和解析)
8.下列描述正确的是
A.液态水分子内存在着氢键,所以其分子比硫化氢分子稳定
B.pH=2的盐酸和pH=12的Ba(OH)2溶液等体积混合后,溶液的pH=7
C.CO2、PCl3、HClO三种分子中所有原子均满足最外层8电子稳定结构
D.NaHCO3溶液和NaAlO2溶液混合后会产生白色沉淀,是因为二者发生了双水解反应
7.常温下,对下列四种溶液的叙述正确的是
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
|
pH |
10 |
10 |
4 |
4 |
A.②、④两溶液相比,两者的kw不相同
B.四种溶液分别加水稀释10倍,pH变化最大的是①和④
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④ 两溶液按一定体积比混合,所得溶液中离子浓度的关系一定有:
c(NH4+)+c(H+)=c(Cl-)+c(OH-)
28、(共16分)烃A的相对分子质量Mr=106;A与C12在FeCl3作催化剂的条件下发生取代反应时,其一氯取代物只有一种。烃B的相对分子质量Mr=28。在一定条件下,它们可完成下列转化(参与反应的其他试剂、生成的次要产物及反应条件均未列出)。请回答:
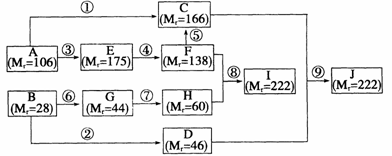
(1)写出下列物质的结构简式:A ,B 。
(2)I和J的相互关系是 。
(3)指出下列反应的发生条件:
A→E: 。
E→F: 。
(4)指出下列物质所含官能团的名称:E中 ,G中 。
(5)①-⑨步反应中属于氧化反应的是 。
(6)写出反应⑧的化学方程式: 。
www.k@s@5@ 高#考#资#源#网
26、(共14分)某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案:
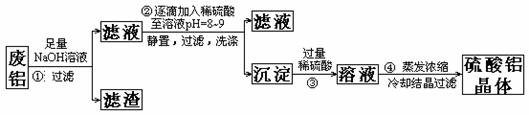
请回答以下问题:
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有 ;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:
;
(3)评价步骤②的操作中难以控制之处 ,请你提出一个合理而比较容易操作的实验方案(药品可任选)
;
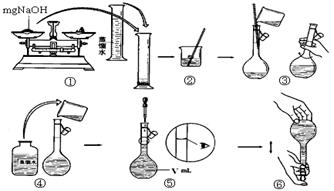
(4)步骤①中使用的NaOH溶液以4mol/L为宜。某同学称量mgNaOH固体配制
V m L 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号) 。 www.k@s@5@ 高#考#资#源#网
29. (15分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
(15分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
① 图甲中条件选定的主要原因是(选填字母序号,下同)____________。
图甲中条件选定的主要原因是(选填字母序号,下同)____________。
A.温度、压强对化学平衡的影响 www.k@s@5@ 高#考#资#源#网
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
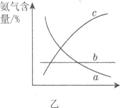 ②改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
②改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
③已知在一定温度下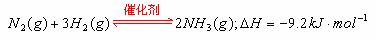 ,向一个容积不变的容器中,加入1 mol N2和4mol H2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的80%。则达到平衡时,放出的热量为 。
,向一个容积不变的容器中,加入1 mol N2和4mol H2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的80%。则达到平衡时,放出的热量为 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
______________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为:______________________________________________________________。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式:_______________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为__________mol。
27、(共15分)下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
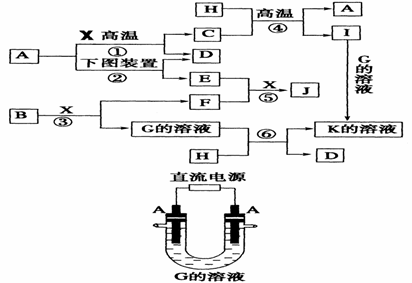
请按要求填空:
(1)写出生成E的电极反应式 ,反应⑤的现象是
(2)反应①的化学方程式是 ,在实验室中引发反应④的操作是
(3)反应⑥中若转移1 mol e-,则被还原的X是 mol。
(4)写出J与氢碘酸反应的离子方程式 。
13、把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2 2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是( )
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的物质的量之比 |
8:1 |
9:2 |
8:1 |
2:9 |
|
原稀盐酸的物质的量的浓度(mol·L-1) |
3.4 |
1.1 |
1.8 |
1.3 |
第Ⅱ卷(非选择题,共58分)
12、2008年诺贝尔化学奖授予美籍华裔钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白方面做出的杰出贡献。下列关于蛋白质的说法中不正确的是
A.蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命
B.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
C.蛋白质水解后可得到多种氨基酸 www.k@s@5@ 高#考#资#源#网
D.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
11、下列说法正确的是( )
A、若HA、H2B两种酸溶液的浓度都是0.1 mol/L,pH依次为1.5和1.8,当NaA和Na2B的浓度都是0.1 mol/L时,Na2B溶液的pH最小
B、常温下,将等物质的量浓度的HA溶液与BOH溶液等体积混合,若所得溶液呈酸性则等体积等物质的量浓度的NaA溶液和BCl溶液中总离子数前者大于后者。
C、碱性氢氧燃料电池的总化学方程式:2H2+O2 2H2O
2H2O
D、等浓度的:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列顺序是①④②⑥③⑤
10、向足量H2SO4溶液中加入100mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-2.92kJ·mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-0.72kJ·mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-73kJ·mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com