
题目列表(包括答案和解析)
8、(14分)(改编:2010·天津高考)
X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素, X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍. M是地壳中含量最高的金属元素.
回答下列问题:
(1) M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示).
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________.
(3)硒(Se)是人体必需的微量元素,与W同一主族,Se原子比W原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族2-5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号).
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:____________________
7、(2010·山东青岛3月)某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6 g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是
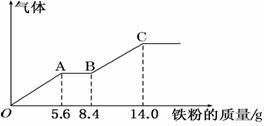

A、原混合酸中HNO3的物质的量为0.1 mol
B、OA段产生的是NO,AB段的反应为Fe+2Fe3+ === 3Fe2+,BC段产生氢气
C、第二份溶液中最终溶质为FeSO4
D、H2SO4浓度为2.5 mol·L-1
6、(改编:2010·四川高考)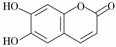 中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:下列叙述正确的是
中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:下列叙述正确的是
A、M分子式为180
B、1 mol M最多能与2 mol Br2发生取代反应
C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H5O5Na3
D、1 mol M与足量NaHCO3反应能生成2 mol CO2
5、(原创)有关下列化学用语正确的是
A、向Ba(OH)2溶液中加入NH4HSO4溶液至刚好沉淀完全的离子方程式:
Ba2+ +OH- +H+ +SO42- =BaSO4 ↓ + H2O
B、用量热计测定盐酸和氢氧化钠反应的反应热:
HCl +NaOH = NaCl + H2O △H=-57.1KJ/mol
C、4mol/L NaAlO2溶液与3.5mol/LH2SO4溶液等体积混合的离子方程式:
4AlO2- + 7H+ = Al(OH)3 ↓ + Al3+
D、K37ClO3 与浓盐酸制备氯气的化学方程式:
K37ClO3 + 6HCl(浓) = K37Cl + 3Cl2 + 3H2O
4、(原创)下列有关实验说法不正确的是
A、在2ml 紫色的COCl2 溶液中加入浓盐酸,可使溶液显蓝色
B、向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2 ,检验火柴头中的氯元素
C、制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜为止,不能将溶液全部蒸干
D、在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,,比较乙醇、苯酚羟基上氢原子的活泼性
3、(原创)下列有关物质的性质叙述不正确的是
A、臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性
B、纤维素水解后的溶液能与新制氢氧化铜溶液,说明纤维素是还原性糖
C、工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质
D、氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物
2、(原创)用NA表示阿伏伽德罗常数。下列说法正确的是
A、标准状况下,11.2L乙烯含有的共用电子对数为NA
B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C、2L1mol/LNa2S 溶液中S2-和HS-的总数为2NA
D、65g锌和一定量浓硫酸反应完全,生成的气体分子数为NA
1、(原创)下列有关说法正确的是
A、世博会中国馆的主体材料钢筋混凝土属于高分子化合物
B、高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一
C、食用地沟油对人体危害极大,是由于含有黄曲霉素和高级脂肪酸
D、大力推广小排放、混合动力的汽车符合“低碳生活”
28. (14分)
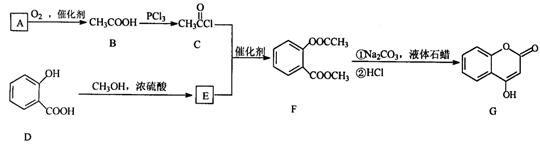
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
(14分)
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
 请回答下列问题:
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构简式是 。
(4)写出F和过量NaOH溶液共热时反应的化学方程式: 。
(5)下列关于G的说法正确的是
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
(6)与D互为同分异构体且含酚羟基、属于酯类的有几种: 种
27.(14分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

A B C D E F G
(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com