
题目列表(包括答案和解析)
26. (14分)在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2 + 3H2 2NH3,,平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
(14分)在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2 + 3H2 2NH3,,平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
(1)通过计算说明起始充入N2和H2的物质的量分别为:x = _________,y = __________。平衡后NH3的体积分数
(2)写出该反应的热化学方程式__________________。
(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该 18.4 kJ(填大于、小于或等于)。
(3)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同。
①若c = 2,在相同的条件下达平衡时,该反应吸收的热量为_________kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为________________________。
25.(16分) U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_________________;XW的电子式为________________;Z元素在周期表中的位置是___________________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)________________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体 www.k@s@5@ 高#考#资#源#网
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)____________________,用一个离子方程式加以证明:_____ ________。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为____ __。
13.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL bmol·L-1的硝酸溶液中,加热使其充分反应(假充NO是惟一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属不能溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y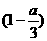
第Ⅱ卷(共58分)
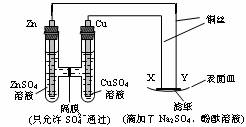
12.如图所示,下列叙述正确的是
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
11.A、B、C、D、E、F为原子序数依次增大的短周期元素,其中A与E同主族,B和F同主族,E与F同周期。已知常温下A与E组成的单质状态不同,D的核电荷数是B的最外层电子数2倍,由F组成的单质是一种重要的半导体材料。下列说法正确的是
A.由A、C、D三种元素组成的化合物一定是共价化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是:E>F>C>D
 D.元素的非金属性由强到弱的顺序是:D>C>F>B
D.元素的非金属性由强到弱的顺序是:D>C>F>B
10.用NA表示阿伏加德罗常数值,下列说法中正确的是 www.k@s@5@ 高#考#资#源#网
A.常温常压下,32gO2和48gO3所含氧原子数都是2NA
B.1molCH3OH在燃料电池负极发生反应时转移的电子总数是4NA
C.0.01molMg在空气中完全燃烧,生成MgO和Mg3N2,转移电子数是0.02NA
D.100mL0.1mol·L-1CH3COONa溶液含CH3COO-的数目是0.01NA
9.下列实验设计或操作能达到实验目的的是
A.除去乙酸乙酯中的乙酸:加入乙醇和浓硫酸,共热,使乙酸全部转化为乙酸乙酯
B.液态溴乙烷中加入NaOH溶液共热几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验溴乙烷中含溴元素
C.除去甲苯中的少量苯酚:加浓溴水,振荡、静置、过滤
D.检验甲酸中是否混有乙醛:可向样品中加入足量稀NaOH溶液中和甲酸后,再做银镜反应实验
8. 18. 反应2X(气)+Y(气)
18. 反应2X(气)+Y(气)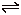 2Z(气)+Q,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示。下列判断正确的是( )
2Z(气)+Q,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示。下列判断正确的是( )
A.T1<T2 P1<P2 B.T1<T2 P1>P2
C.T1>T2 P1>P2 D.T1>T2 P1<P2
7. 下列离子方程式书写正确的是
A.用氨水吸收少量SO2:NH3·H2O + SO2 = NH4+ + HSO3-
B.用两个铜片作电极电解盐酸:Cu + 2H+ 电解==== H2↑+ Cu2+
C.含0.1 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
D.碳酸氢钙溶液中加入足量烧碱溶液:HCO3- + OH- = CO32- + H2O
11.(15分)某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍。A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是 。
(2)已知:
ⅰ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。
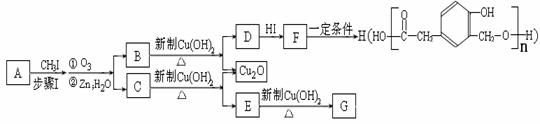
请回答:
① 步骤Ⅰ的目的是 ;
② 若G为气体,且相对分子质量是44,则E的结构简式是 ;E的核磁共振氢谱中有 个吸收峰(填数字);
③ F→H的反应类型是 ;
④ F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式 ;
⑤ A的结构简式是 ;
上述转化中B→D的化学方程式是 。
(3)已知A的某种同分异构体K具有如下性质:
① K与FeCl3反应,溶液呈紫色;
② K在一定条件下可发生银镜反应;
③ K分子中苯环上的取代基上无甲基。
请写出K所有可能的结构简式
ww.k@s@5@ 2011年高考模拟试卷21
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com