
题目列表(包括答案和解析)
11. A、B、C、D四种短周期主族元素,其原子序数依次递增,A元素的原子既能形成简单阳离子、又能形成简单阴离子;B、C、D核电荷数总和为25,且B与C两元素能形成BC、BC2两种常见的共价化合物。以下叙述不正确的是
A.原子半径:D>C>B>A
B B、C、D三种元素形成的化合物是离子化合物
C.B的单质有多种同素异形体
D.A、B、C、D四种元素中的三种形成的化合物溶于水,溶液可能呈酸性、中性或碱性
10. 某温度下,体积为1L的密闭容器中分别加入2molX、 2molY、1molW、1molZ进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);ΔH>0一段时间后反应达到平衡状态,下列叙述正确的是
某温度下,体积为1L的密闭容器中分别加入2molX、 2molY、1molW、1molZ进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);ΔH>0一段时间后反应达到平衡状态,下列叙述正确的是
A.加入少量W,逆反应速率增大,平衡向左移动
B.达到同一平衡时,X和Z的浓度可能分别为2.5mol·L-1和1.5mol·L-1
C.若上述反应在绝热系统中进行,反应达平衡,体系的温度一定降低
D.若缩小容器的体积,达到新的平衡时,气体的平均分子量有可能增大
9.设NA代表阿佛加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(-14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g铜发生氧化还原反应,一定失去2NA个电子 www.k@s@5@ 高#考#资#源#网
④常温常压下,100mL 0.5 mol·L-1 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的原子数为4NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
8.下列叙述正确的是 ( )
A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同
B.25℃时,在CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小于7
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
7.一定能在下列溶液中大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、I-、SO42-、Cl-
28、(14分)已知CH3CHO+ CH3CHO 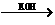 CH3CH (OH)CH2CHO
CH3CH (OH)CH2CHO 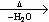 CH3CH=CHCHO。
CH3CH=CHCHO。
兔耳醛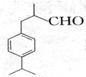 在食品、化妆品等工业中作添加剂,其合成流程(部分产物及反应条件中已略去)
在食品、化妆品等工业中作添加剂,其合成流程(部分产物及反应条件中已略去)

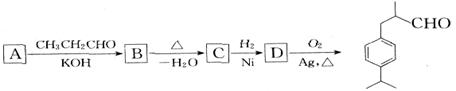
①兔耳醛的分子式是___________;物质A的结构简式是___________________;
②检验C中含有一般的碳碳双键的简要实验步骤是_______________________________。
③物质A有多种同分异构体,其中一类同分异构体,能使FeCl3溶液显紫色,结构中不含-CH3,且苯环上只有两个互为对位的取代基,其结构简式为_________________________________;(有几种写几种)
④C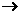 D的化学方程式为______________________________。
D的化学方程式为______________________________。
www.k@s@5@ 高#考#资#源#网
27.(16分)为了测定混有少量KCl杂质的明矾KAl(SO4)2·nH2O的纯度,同时测定n的值,按下列流程进行实验:
(1)晶块磨碎时使用的仪器名称 ;
(2)若加热过程中有固体飞溅出来造成损失,则会使测得的n值偏 ,判断已脱水至恒重的方法是 ;
(3)在加热结束后,如何冷却固体? ;
(4)A溶液是 (填化学式),判断A溶液是否足量的方法是
;
(5)过滤后还需将沉淀洗涤干净,洗涤方法是 ;
(6)通过实验,测得明矾化学式中n值为12,则明矾的纯度为 %。
www.k@s@5@ 高#考#资#源#网
26.(14分)已知某温度下,KW=1×10-13。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
(1)若A为强酸,B为强碱,且a+b=13,两者等体积混合后,溶液的pH=________;若此时溶液中碱的阳离子浓度大于酸根阴离子浓度,其原因可能是(用文字表述)________________。
(2)若A为强酸,B为强碱,二者按体积比为1:10混合后溶液显中性,则a+b=____。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式 为__________________。
(4)在(3)的混合溶液中,微粒浓度大小关系一定正确的是___________(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-) ④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-) ⑥c(MOH)=c(H+)-c(OH-)
25.(14分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如图:
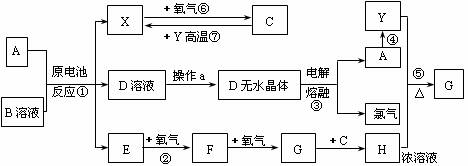
(注意:其中有些反应的条件及部分生成物被略去)请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为:__________。
(2)从D溶液制备D的无水晶体的“操作a”为___________。
(3)反应②方程式______________________ 。(4)反应⑤方程式_______________________。
(5)原电池反应①中正极的电极反应式为____________________________________。 www.k@s@5@ 高#考#资#源#网
13.已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-Q1kJ/mol
2H2(g)+O2(g)===2H2O(g);ΔH=-Q2kJ/mol 2H2(g)+O2(g)===2H2O(l);ΔH=-Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为( )kJ。 ( )
A.0.4Q1+0.05Q3 B.0.4Q1+0.05Q2 C.0.4Q1+0.1Q3 D.0.4Q1+0.1Q2
第Ⅱ卷(非选择题,共58分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com