
题目列表(包括答案和解析)
11、对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠露置在空气中很稳定,不发生任何变化。
假设②:固体硫化钠易被空气中的氧气氧化为单质硫。
假设③:固体硫化钠易被空气中的氧气氧化为亚硫酸钠。
假设④:固体硫化钠易被空气中的氧气氧化为硫酸钠。
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎。
②将研钵中的样品露置在空气中两天。
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡。
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少。
回答下列问题:
(1)硫化钠俗称臭碱,表明它是碱性物质。用离子方程式表示它的溶液呈碱性的原因:___________________________________________________。
(2)由实验现象分析,上述四种假设中,肯定不成立的是假设__________。
(3)写出加入盐酸后可能产生气泡的两个离子方程式:
____________________________________,__________________________________。
(4)解释加塞振荡后产生浑浊,且气泡大量减少的原因________________________,化学方程式为______________________________________________。
(5)如果要检验样品中是否还有Na2SO4存在,实验方法是
______________________________________________________________________ ________________________________________________________________________。
10、试用简单实验证明在醋酸溶液中存在着: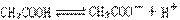 的电离平衡。(要求写出简要操作,现象及实验能说明的问题)。
的电离平衡。(要求写出简要操作,现象及实验能说明的问题)。
9、为测定由CO、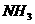 、
、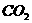 、
、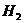 组成的混合气体中各成分的体积分数,请用下列装置设计一个简单实验(装置不能重复使用,所用试剂均过量)。
组成的混合气体中各成分的体积分数,请用下列装置设计一个简单实验(装置不能重复使用,所用试剂均过量)。

已知存在下列反应: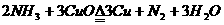 请回答:
请回答:
(1)混合气体通过各装置的顺序依次是( )→( )→( )→( );
(2)写出装置③中有关反应的离子方程式______________________________________;
(3)装置③和④的位置不可互换,其原因是__________________________________。
(4)若①②③④装置的质量分别改变了m1、 m2、m3、m4,则四种气体中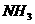 、
、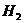 的物质的量的计算式为_____________________________________。
的物质的量的计算式为_____________________________________。
8、某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下:
表一 废水中各物质的含量
|
物质 |
FeSO4 |
H2SO4 |
Ag2SO4 |
Al2(SO4)3 |
污泥 |
|
质量分数/(%) |
15.0 |
7.0 |
0.65 |
0.34 |
5.0 |
表二 FeSO4和Al2(SO4)3在水中的溶解度
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
FeSO4的溶解度 |
15.6 |
20.5 |
26.5 |
32.9 |
40.2 |
48.6 |
|
Al2(SO4)3的溶解度 |
31.2 |
33.5 |
36.4 |
40.4 |
45.7 |
52.2 |
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、
烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag。
(1)请填写下列空白,完成得到Ag的实验方案:
①将有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是 ;
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③ ,目的是使Ag+全部还原为金属Ag;
④ ,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到比较纯净的FeSO4·7H2O晶体:
⑤将第 步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3~4,
滤出FeSO4·7H2O晶体;
⑥
得到较纯净的FeSO4·7H2O晶体。
(3)步骤②中能否用变通自来水洗涤滤渣? (填“能”或“否”),理由是
(4)步骤③中有关化学反应的离子方程式是
(5)在步聚⑤中,加少量硫酸调整pH的目的是 。
(1)观察收集到的气体呈 色,若向下用力压活塞,发现气体的颜色先变深,后变浅,原因是 。
(2)进行实验1后,为验证NO2气体与H2O的反应,将注射器尖导管插入水中,打开活塞K,然后吸取少量的水、关闭阀门K,振荡后发现气体变为无色,且气体的体积缩小,
请写出发生反应的离子方程式: 。
(3)为了验证进行实验②后注射器中的气体,请设计一实验方案加以验证:
12、已知在酸性条件下有以下反应关系:
(1)KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2
(2)Br2能将I-氧化为I2
(3)KIO3也能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2
①KBrO3、Br2、KIO3、I2氧化能力由强到弱的顺序为________________________________________。
②现向含有1mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得的产物也不同。试将讨论的结果填入下表。
|
编号 |
A的取值范围 |
产物的化学式(或离子符号) |
|
A |
|
I2、Br- |
|
B |
1/6<a<1/5 |
|
|
C |
|
|
|
D |
|
I2、IO3-、Br2 |
|
E |
|
|
③若产物中碘单质和碘酸钾的物质的量相等,a的值为__________________。
④当a的值为1时,其产物及物质的量分别为__________________________________。
11、 t℃时,将3molA和2molB气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) 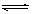 xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB, 并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB, 并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)________α(B)(填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C)都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t℃时,若向原平衡混合物的容器中再充人amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充人__________(填A或B)________mol(用a表 示),达新平衡时,A的物质的量为n(A)___________(用含a的式子表示)。
10.我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
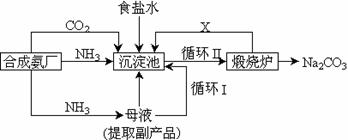
(1)沉淀池中发生反应的方程式为----------------------------------------;
(2)该实验得到的纯碱中含有氯化钠,甲同学设计装置Ⅰ,拟通过测定烧杯中氢氧化钠溶液的增重来测定样品中碳酸钠的含量,但该实验存在明显不足,试举出该装置引起误差的两个主要原因:
①------------------------------------------------------------------------------
②------------------------------------------------------------------------------
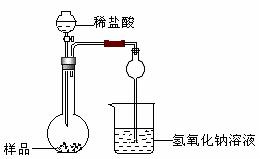
Ⅰ
(3)乙同学设计的测定样品中纯碱含量的方法如图Ⅱ,试回答:
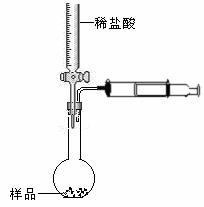
Ⅱ
①检查该装置气密性的方法为:----------------------------------------------------;
②设滴定管的其始读数为V1mL,终了读数为V2mL,注射器测定排除的气体为V3mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数的表达式为------------------(用含V1 、V2 、V3、m的代数式表示)
(4)丙同学设计的测定样品中纯碱含量的方法如图Ⅲ,并在广口瓶中的水上面滴加少量植物油,试回答:
①你认为植物油的作用是------------------
②为减小误差,读取量筒中水的体积时的注意事项有:
-------------------,-------------------------------
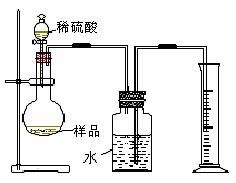
Ⅲ
9.现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
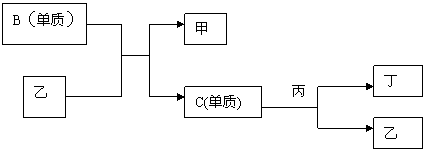
又知甲、乙、丙分子均含有10个质子。
(1)根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是 - (填写选项的编号,下同)(①A ②B ③C ④D)
写出转化关系图中已确认的反应的化学方程式:
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是 。
A.化合物甲与丙、乙与丙均能够发生反应
B.化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
C.通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
D.单质C和化合物丁不能共存。
依据该条件推断,第四种元素在周期表中的位置为 。
(3)按(2)中的另外三个补充条件推断第四种元素,丙的空间构型为___________。
8、在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
A.平衡向正反应方向移动了
B.平衡向逆反应方向移动了
C.物质B的质量分数增加了
D.a<b
第Ⅱ卷.非选择题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com