
题目列表(包括答案和解析)
9.设NA为阿伏加德罗常数,下列叙述中正确的是
①106 g Na2CO3晶体中的离子总数大于3NA ②标准状况下,16 g O3和O2混合气体中含有的氧原子数为NA
 ③将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA
③将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA
④1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
A.①② B.①③ C.②④ D.③④
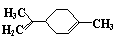
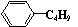 10.柠檬烯是一种食用香料,其结构简式如右图。有关柠檬烯的分析正确的是
10.柠檬烯是一种食用香料,其结构简式如右图。有关柠檬烯的分析正确的是
A.它的一氯代物有6种 B.它和丁基苯( )互为同分异构体
C.它的分子中所有的碳原子一定在同一个平面上 D.一定条件下,它分别可以发生加成、取代、氧化、还原等反应
8.下列实验室除杂(括号内为少量杂质)的方案正确的是
|
|
提纯物质 |
除杂试剂 |
提纯方法 |
|
A |
苯(苯酚) |
碳酸钠溶液 |
过滤 |
|
B |
Al(Fe) |
氢氧化钠溶液 |
过滤 |
|
C |
CO2(NO2) |
水 |
洗气 |
|
D |
乙酸乙酯(乙醇) |
水 |
水洗、分液 |
7.下列各组离子,能在强碱性溶液中大量共存,滴加稀硫酸会产生气体和沉淀的是
A.Al3+、AlO2-、Cl-、SO32- B.Na+、S2-、Br-、SO42- C.K+、Ca2+、NO3-、HCO3- D.K+、SiO32-、Cl-、CO32-
6.下列有关说法中,正确的是
A.变质的油脂有难闻的特殊气味,是因为油脂发生了水解反应 B.稀双氧水可用于清洗伤口,以达到杀菌、消毒的目的
C.洗衣粉、橡胶、阿司匹林都只能由人工合成得到 D.糖类、蛋白质在一定条件下都能发生水解反应
18、(每空1分,共4分)
 (1)2N(g) M (g)
(1)2N(g) M (g)
(2)0.1mol/(L·S) (3)大于
(4)增大
19(共8分)
20(每空2分,共14分)
(A)
(B)
21实验题:(每空2分,共14分)
(1)请在 右框中画出一个原电池装置图,
右框中画出一个原电池装置图,
(标出正.负极)
(2)①检验装置的气密性,挤压胶头使硫酸滴入试管,并检验H2纯度
③待Ⅲ中溴水褪色并产生浑浊时撤出导管
(2)利用浓硫酸溶于水放热,加速H2的生成
(3)溴水褪色,产生淡黄色浑浊;溴的非金属性比硫强;H2S +Br2===S↓+2H+ +2Br-
22 (8分) ① 9.75g ②0.3mol ③0.75mol/L ④0.3mol/L.min
17、(每空2分,共4分)①②④ ,③⑤⑥
22.(8分) 在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
① 产生这些气体消耗的锌的质量是多少?
 ② 通过导线的电子的物质的量是多少?
② 通过导线的电子的物质的量是多少?
③ 原稀硫酸的物质的量浓度是多少?
④ 若整个反应用时5分钟,则用H+表示该反应的化学反应速率为多少?
吉安一中2010-2011学年度下学期期中考试
高一化学答案卷
21.实验题:(每空2分,共14分)
某校兴趣小组为探究元素的金属性和非金属性,设计如下实验
实验一:利用原电池原理可得出“金属性:Mg > Al”,
请在右框中画出一个原电池装置图,(标出正、负极及电解质溶液),能够通过观察实验
现象判定金属性:Mg >Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
实验二:
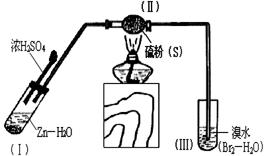 下图是用来制取硫化氢并比较硫元素与溴元素非金属性强弱的实验装置。(已知硫化氢气体可与溴水反应置换出硫)
下图是用来制取硫化氢并比较硫元素与溴元素非金属性强弱的实验装置。(已知硫化氢气体可与溴水反应置换出硫)
(1)将下列操作步骤补充完整:
① 。
②用大火加热使硫沸腾与H2化合。
③_________________ 。
④停止加热并做善后处理。
(2)Ⅰ中制氢气不直接用稀硫酸
与锌反应,而将浓硫酸滴入
水中,其优点是 。
(3)Ⅲ中产生的现象是__________________,由此得出的结论是______ ________,反应的离子方程式为_______ _________。
_________。
20.(B)(14分)有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中:X、Z是金属元素;V和Z元素原子的最外层电子都只有一个,W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半,由此推知:
(1)写出V的元素符号
,X的原子结构示意图
。这五种元素中,原子 的还原性最强的是(写元素符号)
,气态氢化物中稳定性较弱的是(写化学式)
。
的还原性最强的是(写元素符号)
,气态氢化物中稳定性较弱的是(写化学式)
。
(2)用电子式 表示下列物质的形成过程:
表示下列物质的形成过程:
由V、W构成三原子分子 ,
Y、Z元素形成的化合物 。
(3)X的最高价氧化物的水化物与Z的最高价氧化物的水化物反应的离子方程式
。
20.(A) (14分) 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
⑴、该融雪剂的化学式是______________;X与氢元素形成的化合物的电子式是____________。
⑵、元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是_______;D与E能形成一种非极性分子,该分子的结构式为______________ _____;D所在族元素的氢化物中,沸点最低的氢化物的化学式是___________________。
_____;D所在族元素的氢化物中,沸点最低的氢化物的化学式是___________________。
⑶、元素W与Y同周期,其单质是一种良好的半导体材料;元素Z的单质分子Z2中由3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是___________________。
⑷、元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,此反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com