
题目列表(包括答案和解析)
2.(16分)Ⅰ、下列实验正确的是 (填序号,双选)。
A.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,制取Fe(OH)3胶体
B.苯酚沾到皮肤上,先用酒精清洗,再用水冲洗
C.将l0g ZnSO4·7H2O溶解在90g水中,配制10%ZnSO4溶液
D.向稀硫酸中加几滴CuSO4溶液,可提高纯锌与稀硫酸的反应速率
Ⅱ、Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出碱性中Br2氧化Na2SO3的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;
1.(16分)下面是某同学检验海水中溴离子的实验,请你参与他的探究:
(1)由于溴离子在海水中浓度很低(0.067g/L),要先取海水样品(设取70mL)进行浓缩,浓缩时下面的仪器 是不需要的(填编号):
A.玻璃棒 B.三脚架 C.酒精灯 D.蒸发皿 E.100mL烧杯
(2)取浓缩后的海水(假设剩余10mL左右)进行氧化和萃取。
① 下列试剂都可以氧化浓缩后海水中的溴离子,实验中最好选 (填编号):
A.氯水 B.双氧水 C.酸性高锰酸钾溶液
②加入一定量氧化剂后,对氧化后的溶液进行假设和实验:
假设1:溶液中全部为Br-; 假设2:溶液全部为Br2
假设3:溶液中 。
③设计方案、进行实验,验证假设:请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:10mL量筒、小烧杯、试管、胶头滴管、分液漏斗;无水乙醇、裂化汽油、苯、0.10mol/LAgNO3、0.10mol/LHNO3
|
实验步骤 |
预期现象和结论 |
|
步骤1:用量筒取样品溶液6mL于试管中,再取
|
若上层有机层出现橙色或橙红色,则假设2或假设3成立;
|
|
步骤2:将上述液体倒入
|
|
29.(16分)某芳香族化合物A(C9H10O3),且有如下转化关系:
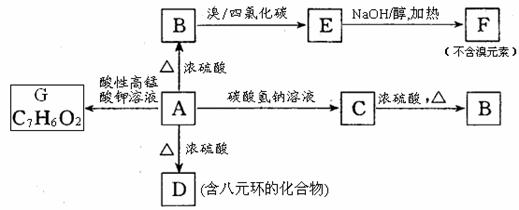
(1)A中含氧官能团的名称是_______________。
(2)写出A、E的结构简式________________________、_________________________。
(3)A→B、A→D的反应类型分别是___________________、____________________。
(4)写出E→F、C→B的化学反应方程式
_____________________________________________________、________________________________________________________。
(5)W为B的同分异构体,且满足下列条件:
①能与氯化铁反应显紫色;②苯环上一氯代物只有一种;③1molW能与2molNaOH反应;④除苯环外无其他环状结构。
写出W所有可能的结构简式____________________________________。
28.(14分)硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
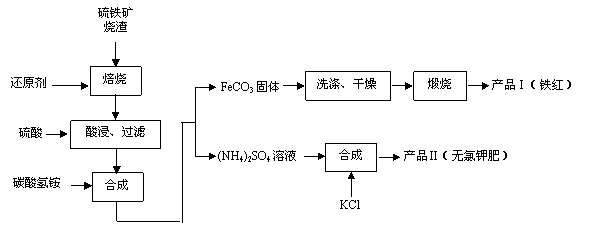

已知相关几种盐的溶解度随温度变化的曲线如下图所示:



(1)煅烧FeCO3生成产品I的化学反应方程式为___________________________________;实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有_______________________。
(2)为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,接着____________________
________________________________________________。(填具体操作过程)
 (3)分离粗产品Ⅱ时承接滤液的烧杯中应加入少量________,分离粗产品Ⅱ后的滤液冷却至室温后,进行减压抽滤,得粗产品Ⅲ。所用的装置如右图所示,若实验过程中发现倒吸现象,应采取的措施是 。
(3)分离粗产品Ⅱ时承接滤液的烧杯中应加入少量________,分离粗产品Ⅱ后的滤液冷却至室温后,进行减压抽滤,得粗产品Ⅲ。所用的装置如右图所示,若实验过程中发现倒吸现象,应采取的措施是 。
(4)若向(NH4)2SO4溶液中加入FeSO4溶液后可制得硫酸亚铁铵晶体,两溶液混合后,小火加热,在蒸发皿中蒸发浓缩至_____________________________(填现象),应立即停止加热,将溶液静置,冷却,结晶,抽滤,并用少量酒精洗涤晶体。其中最后一步用少量酒精洗涤晶体目的是____________________________。
(5)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.400 g Cu2S和CuS的混合物在酸性溶液中用60 .0mL 0.100 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.500 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+-Mn2++Fe3++H2O(未配平),求V的取值范围为 。
27.(14分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol ks**5u
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:



 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
 ①前2s内的平均反应速率v (N2) = ___________________。
①前2s内的平均反应速率v (N2) = ___________________。
 ②在该温度下,反应的平衡常数K =
。(只写出计算结果)
②在该温度下,反应的平衡常数K =
。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明 (填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
 下列说法错误的是 。
下列说法错误的是 。
A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
26.(14分)短周期元素A、B、C、D、E在元素周期表中的位置如下图所示:

请回答下列问题:
(1)描述D在元素周期表中的位置:_____________________
(2)比较A、C、D元素简单离子半径的大小:______>______>______(填微粒符号)
(3)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学反应方程式为_______________________________________________.
(4)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:________,该阳离子中存在的化学键有_____________,并写出该阳离子与F氢化物的水溶液反应的离子方程式: 。
(5)在Fe和Cu 的混合物中加入一定量的C的最高价氧化物的水化物稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后,剩余金属m2g。下列说法正确的是
A.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Cu2+
B.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+
C.m1一定大于m2
D.剩余固体m1g中一定有单质铜,剩余固体m2g中一定没有单质铜
13.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1∶6 B.1∶7 C.2∶11 D.16∶25
12.下列叙述正确的是( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:
c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
D.用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Vb<10Va
11.化合物A、B、C、D各由两种元素组成,甲、乙、丙是短周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
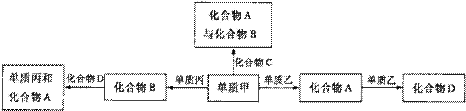
A.甲、乙、丙三种单质的晶体一定是分子晶体
B.上述转化关系所涉及的化合物中有一种是电解质
C.上图所示的五个转化关系中,有三个是化合反应
D.上图所示的五个转化关系中,均为氧化还原反应
10.家蝇的雌性信息素可用芥酸(来自菜籽油)与羧酸X在浓NaOH溶液中进行阳极氧化得到。电解总反应式为:

则下列说法正确的是( )
A.X的结构简式为C3H5COOH
B.雌性信息素可能是烯烃,但不能使溴水褪色
C.电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+
D.阴极的还原产物为H2和OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com